
【题目】Ⅰ.过氧化氢是用途很广的绿色氧化剂,它的水溶液俗称双氧水,常用于消毒、杀菌、漂白等。试回答下列问题:
(1)写出在酸性条件下H2O2氧化氯化亚铁的离子反应方程式_______________
(2)Na2O2,K2O2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。则上述最适合的过氧化物是______________
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上,实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%70%的过氧化氢溶液中,则该反应的化学方程式_______
Ⅱ. 某厂废水中含KCN,其浓度为650mgL1现用氯氧化法处理,发生如下反应(其中N均为3价):
(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是____________________.
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:
___KOCN+___KOH+___ Cl2→_____CO2+_____N2+_____KCl+______ H2O
(3)若将10m3含KCN的浓度为650mgL1的废水中KCN氧化除去,需要标准状况下的氯气的体积为______________________L.
【答案】H2O2+2Fe2++2H+═2Fe3++2H2O BaO2 Ca(OH)2+2HCHO+2H2O2=Ca(HCOO)2+4H2O C 2 4 3 2 1 6 2 5600
【解析】
Ⅰ(1)在酸性条件下H2O2氧化氯化亚铁生成铁离子和水。
(2)实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得,说明生成了沉淀,应该为硫酸钡沉淀。
(3)实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%70%的过氧化氢溶液中反应生成甲酸钙和水。
Ⅱ(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O,KCN中碳+2价,化合价升高变为KOCN中碳+4价,即得被氧化的元素是C。
(2)投入过量液氯,氯化合价降低,1个氯气降低两个价态,KOCN中一个氮化合价升高3个价态,得到1个氮气化合价升高6个价态,根据化合价升降守恒得到系数,氯气前面配3,氮气前面系数配1,再根据守恒配平。
(3)根据KCN+Cl2+2KOH═KOCN+2KCl+H2O和2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O 知KCN和氯气的反应的物质的量之比为1:2.5,10m3含KCN的浓度为650mgL1的废水中KCN物质的量=mM=![]() =10mol,故氯气的物质的量为25mol得标准状况下的氯气的体积。
=10mol,故氯气的物质的量为25mol得标准状况下的氯气的体积。
Ⅰ(1)在酸性条件下H2O2氧化氯化亚铁生成铁离子,其离子反应方程式H2O2+2Fe2++2H+═ 2Fe3++ 2H2O,故答案为:H2O2+2Fe2++2H+═ 2Fe3++ 2H2O。
(2)实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得,说明生成了沉淀,则上述最适合的过氧化物是BaO2,故答案为:BaO2。
(3)实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛溶液依次加入质量分数为30%70%的过氧化氢溶液中反应生成甲酸钙和水,则该反应的化学方程式Ca(OH)2+2HCHO+2H2O2= Ca(HCOO)2+4H2O,故答案为:Ca(OH)2+2HCHO+2H2O2= Ca(HCOO)2+4H2O。
Ⅱ(1)KCN+2KOH+Cl2=KOCN+2KCl+H2O,KCN中碳+2价,化合价升高变为KOCN中碳+4价, 被氧化的元素是C,故答案为:C。
(2)投入过量液氯,氯化合价降低,1个氯气降低两个价态,KOCN中一个氮化合价升高3个价态,得到1个氮气化合价升高6个价态,根据化合价升降守恒得到系数,氯气前面配3,氮气前面系数配1,再根据守恒配平,2 KOCN + 4 KOH+3Cl2 = 2CO2 + 1 N2 + 6KCl + 2 H2O,故答案为:2;4;3;2;1;6;2。
(3)根据KCN+Cl2+2KOH═KOCN+2KCl+H2O和2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O 知KCN和氯气的反应的物质的量之比为1:2.5,10m3含KCN的浓度为650mgL1的废水中KCN物质的量=mM=![]() =10mol,故氯气的物质的量为25mol,则标准状况下的氯气的体积V=25mol×22.4L/mol=5600L,故答案为5600。
=10mol,故氯气的物质的量为25mol,则标准状况下的氯气的体积V=25mol×22.4L/mol=5600L,故答案为5600。


科目:高中化学 来源: 题型:
【题目】某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )

A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C. 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾晶体(FeSO4·7H2O,M=278g/mol)是治疗缺铁性贫血药品的重要成分。实验室利用硫酸厂的烧渣(主要成分为Fe2O3及少量FeS、SiO2),制备绿矾的过程如下:
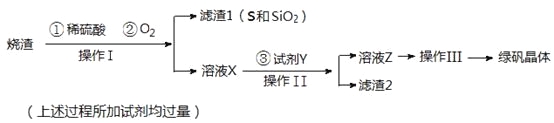 试回答:(1)操作Ⅰ为_____________(填写操作名称)。
试回答:(1)操作Ⅰ为_____________(填写操作名称)。
(2) 试剂Y与溶液X反应的离子方程式为__________________________________。
(3)检验所得绿矾晶体中含有Fe2+的实验操作是________________________________。
(4)操作Ⅲ的顺序依次为:_______________、冷却结晶、过滤 、__________、干燥。
(5)某同学用酸性KMnO4溶液测定绿矾产品中Fe2+含量:
a.称取11.5g绿矾产品,溶解,配制成1000mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①步骤a配制溶液时需要的玻璃仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需___________。
②该同学设计的下列滴定方式,最合理的是____________(夹持部分略去)(填字母序号)。
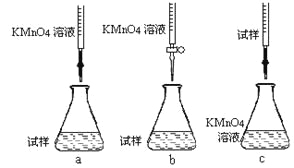
③滴定时发生反应的离子方程式为:_______________________________________。
④判断此滴定实验达到终点的方法是_____________________________;若在滴定终点读取滴定管刻度时,俯视KMnO4溶液液面,其它操作均正确,则使测定结果________(填“偏高”“偏低”“无影响”)。
⑤计算上述样品中FeSO4·7H2O的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.字母 A~K 代表常见物质,在一定条件下能发生如图所示变化

已知:反应②中A为红棕色粉末,B为金属单质,且n(A):n(B)=1:2,反应③和反应④均在水溶液中进行。
(1)保存 J 的方法是:_____。
(2)写出反应②的化学方程式:_____。
II.某研究性学习小组的同学以 Fe(NO3)3溶液来探究 Fe3+能否氧化 Ag 为题。他们选用少量的Fe(NO3)3 溶液与做过银镜反应的试管进行实验。现象:银镜部分溶解,试管上方出现少量淡淡的红棕色气体。
(1)出现少量淡淡的红棕色气体,该气体是_____。
(2)若 Fe3+能否氧化 Ag,只需证明:_____方法是:_____
Ⅲ. 铁红是一种红色颜料,其成分是 Fe2O3 ,将一定量的铁红溶于 180mL 5mol·L-1 盐酸中,在加入一定量铁粉恰好溶解,收集到 3.36L(标准状况)气体。
(1)按反应顺序写出离子方程式_____
(2)反应后的溶液中一定没有 Fe3+,理由是_____
(3)参加反应的铁粉的质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定精确度也越来越高,现有一种简单可行的测定方法,具体步骤为:
(1)将固体NaCl研细、干燥后,准确称取mgNaCl固体并转移到定容仪器A中。
(2)用滴定管向A仪器中滴加苯,不断振荡,继续加苯至A仪器的刻度线,计算出NaCl固体的体积为Vcm3。
①步骤(1)中A仪器最好用__________(仪器名称)。
②步骤(2)中用酸式滴定管好还是碱式滴定管好,__________,理由是______________。
③能否用胶头滴管代替步骤(2)中的滴定管__________;理由是____________________。
④已知NaCl晶体的结构如上图所示,用X射线测得NaCl晶体中靠得最近的Na+与Cl-间的平均距离为acm,则用上述测定方法测得阿伏加德罗常数NA的表达式为:NA=______mol-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒元素(Se)是第4周期ⅥA族元素,单质有红硒、黑硒和灰硒,灰硒是良好的半导体材料,硒最特殊的性质是在光照射下导电性可提高近千倍,可用于制造光电管。请回答下列问题:
(1)基态Se原子价电子的轨道表示式为__。
(2)As和Se是同一周期元素,As的第一电离能比Se大,原因是___。
(3)硒在空气中燃烧能生成SeO2,常温下,SeO2是易挥发的白色固体,熔点为340~350℃,315℃时升华,则SeO2固体是___晶体;写出一种与SeO2互为等电子体的阴离子的化学式__。
(4)H2SeO4和H2SO4相似,是一种不易挥发的强酸。SeO42-的空间构型为___,中心原子的杂化方式为___。
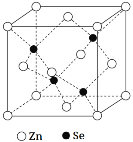
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,Zn原子的配位数为___,若该晶胞密度为ρg·cm-3,硒化锌的摩尔质量为Mg·mol-1,用NA代表阿伏加德罗常数,则晶胞参数a(即晶胞的边长)为___nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能大量含有的离子如下表所示:
阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
阴离子 | Cl-、OH-、CO32-、AlO2- |
为探究其成分,某同学将Na2O2逐渐加入到上述混合溶液中并微热,产生沉淀和气体的物质的量与加入Na2O2的物质的量的关系分别如图所示。
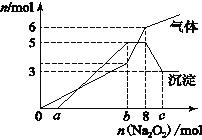
(1)该溶液中一定含有的阳离子是________________________________,其对应物质的量浓度之比为 ____________,溶液中一定不存在的阴离子是_______________________。
(2)写出沉淀减少的离子方程式 ________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,金属单质X和非金属单质Y能够反应,生成化合物Z,Z能与水发生水解反应生成气体G和白色沉淀P(如下框图所示),已知气体G与空气之密度比约为1.17。请填空:

(1)组成单质X和Y的元素分别属第____________族和第___________族;
(2)Z与水发生水解反应方程式_____________________;
(3)每生成1mol的化合物Z,反应中转移_________________mol的电子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com