
【题目】在一定温度下,某反应达到了化学平衡,其反应过程对应的能量变化如图。
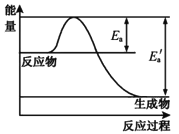
下列说法正确的是( )
A.Ea为逆反应活化能,Ea′为正反应活化能
B.温度升高,逆反应速率加快幅度大于正反应加快幅度,使平衡逆移
C.所有活化分子的平均能量高于或等于所有分子的平均能量
D.该反应为放热反应,ΔH=Ea′-Ea
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
(1)汽车内燃机工作时发生反应:N2(g)+O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
①5min内该反应的平均速率υ(NO)=___;在T℃时,该反应的平衡常数K=___。
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是___(填序号)。
a.混合气体的密度
b.混合气体的压强
c.正反应速率
d.单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳化合物在生产生活中广泛存在,Andren Dasic等提出在M+的作用下以N2O为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图所示,请回答下列问题。
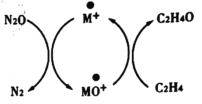
(1)已知N2O(g)+M+(s)=N2(g)+MO+(s) ΔH1=+678kJ·mol-1
MO+(s)+C2H4(g)=C2H4O(g)+M+(s) ΔH2=-283kJ·mol-1
请写出在M+的作用下以N2O为氧化剂氧化乙烯生成乙醛的热化学方程式:_________
(2)已知在含少量的I2溶液中,反应CH3CHO (aq)![]() CH4 (g) +CO (g)分两步进行:第Ⅰ步反应CH3CHO (aq) +I2 (aq) →CH3I (l) +HI (aq) +CO (g) (慢反应),第II步为快反应。
CH4 (g) +CO (g)分两步进行:第Ⅰ步反应CH3CHO (aq) +I2 (aq) →CH3I (l) +HI (aq) +CO (g) (慢反应),第II步为快反应。
①决定此反应快慢的是第______(填“Ⅰ”或“II”)步反应
②请写出第II步反应的化学方程式:_________
(3)若物质与氧原子的结合力用OA表示,氧原子与N2生成N2O的结合力OA(N2) =167.4 kJ·mol-1, 氧原子与乙烯生成乙醛的结合力OA (C2H4) = 473 kJ·mol-1,则可做该反应催化剂的M+与氧原子的的结合力OA (M+)的值应满足________,使用催化剂会使该反应的活化能________ (填“增大”、 “减小”、“不变”)。
(4)某2L容器中发生: 2CO2(g)![]() 2CO (g)+O2 (g),2molCO2在不同温度下平衡分解的情况如图所示。
2CO (g)+O2 (g),2molCO2在不同温度下平衡分解的情况如图所示。
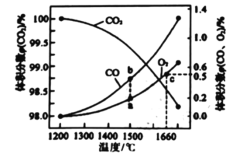
①恒温恒容条件下,能表示该可逆反应达到平衡状态的是______(填标号)
A.CO体积分数与O2体积分数的比值保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.容器内碳元素的质量分数保持不变
②图中a、b、c三点的平衡常数K(a)、K(b)、K(c)的大小关系为_______
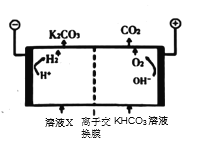
③为实现CO2减排,目前较成熟的方法是用高浓度的K2CO3溶液吸收工业烟气中的CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图,用必要的文字和化学用语简述![]() 在阴极区再生的原理____________。
在阴极区再生的原理____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 ;
(2)E2+离子的价层电子轨道表示式是 ,F原子的电子排布式是 ;
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的分子模型为 ;
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ;
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 ;
(6)某种化合物由D,E,F三种元素组成,其晶胞 如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:d= g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA是阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.1molL-1H2C2O4溶液中含C2O![]() 离子数为0.1NA
离子数为0.1NA
B.2molNO与2molO2在密闭容器中充分反应,转移的电子数为8NA
C.32gS8与S6(![]() )的混合物中所含共价键数目为NA
)的混合物中所含共价键数目为NA
D.标准状况下22.4L氯气与甲烷的混合气体,光照时充分反应生成HCl分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是( )

A. ①②③ B. ③②① C. ②①③ D. ①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。回答下列问题:
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
(5)氮化铁晶体的晶体结构示意图如图所示。该晶体中铁、氮的微粒个数之比为______。
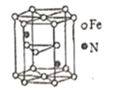
(6)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
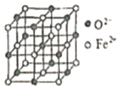
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气(NH3)是一种重要的化工原料,广泛应用于制氮肥、制药、合成纤维等。请回答下列问题:
(1)2molNH3在标准状况下的体积是___。
(2)2molNH3的质量是___,其中所含氢元素的质量是___。
(3)2molNH3所含的氨分子数为___,电子数为___。
(4)工业上用反应N2+3H2 ![]() 2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。


(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。指明使用镁条和氯酸钾的目的是 ______________________。
(2)某同学用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液未见血红色。为测定该实验所得 “铁块”中铁元素含量,设计实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
Fe2+ | Fe3+ | Al3+ | Mg2+ | |
开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择________,试剂B应选择_______。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水
② 写出反应Ⅱ的离子方程式_____________________。
③ 设计简单实验证明M的成分是Fe2O3而非Fe3O4。
操作 | 预期现象 |
取少量M固体于试管中,向其中加入________________;观察。 | 固体完全溶解,溶液呈黄色。 |
继续向上述溶液中滴入_________________,振荡观察 | ______________________ |
④ 上述实验应灼烧至M质量不变,则能证明M质量不变的标志是____________。
⑤ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com