
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
Ⅰ.C(s)+CO2(g)![]() 2CO(g) ΔH=+172.5kJ·mol-1
2CO(g) ΔH=+172.5kJ·mol-1
Ⅱ.CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
请回答:
(1)一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应Ⅱ,2min时达到平衡,测得容器中CuO的物质的量为0.5mol。
①0-2min内,用CO表示的反应速率v(CO)=___。
②CO2的平衡体积分数φ=___。
(2)向5L密闭容器中加入1molC和1molCO2,发生反应Ⅰ。CO2、CO的平衡分压(p)与温度(T)的关系如图所示(平衡分压=物质的量分数×总压强)。
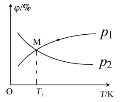
①能表示CO2的平衡分压与温度关系的曲线为___(填"p1”或“p2”),理由是___。
②温度为T1时,该反应的平衡常数K=___;温度升高,K___(填“变小”、“变大”或“不变”)
③实验测得,v正=v(CO2)消耗=k正c(CO2),v逆=v(CO)消耗=k逆c2 (CO),k正、k逆为速率常数,受温度影响,则温度为T1时,k正/k逆=___。
【答案】0.075mol/(L·min) 75% p2 该反应为吸热反应,温度升高,平衡正向移动,CO2的平衡平衡体积分数减小,平衡分压减小 ![]() mol/L 变大 K=
mol/L 变大 K=![]() mol/L
mol/L
【解析】
(1)一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应Ⅱ,2min时达到平衡,测得容器中CuO的物质的量为0.5mol。
CO(g)+2CuO(s)![]() Cu2O(s)+CO2(g)
Cu2O(s)+CO2(g)
开始时的量(mol) 1 2 0
改变的量(mol) 0.75 1.5 0.75
平衡时的量(mol) 0.25 0.5 0.75
①0-2min内,用CO表示的反应速率v(CO)=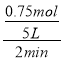 =0.075mol/(L·min);
=0.075mol/(L·min);
②CO2的平衡体积分数φ=![]() =75%;
=75%;
(2)①该反应为吸热反应,温度升高,平衡正向移动,CO2的平衡平衡体积分数减小,平衡分压减小,故能表示CO2的平衡分压与温度关系的曲线为p2;
②温度为T1时,CO2、CO的平衡分压(p)相等,则物质的量相等;设CO2的转化率为x,则1-x=2x,解得x=![]() mol,即CO2、CO的平衡浓度均为
mol,即CO2、CO的平衡浓度均为![]() mol/L,该反应的平衡常数K=
mol/L,该反应的平衡常数K=![]() =
=![]() mol/L;
mol/L;
反应C(s)+CO2(g)![]() 2CO(g) ΔH=+172.5kJ·mol-1为吸热反应,温度升高,平衡正向移动,K变大;
2CO(g) ΔH=+172.5kJ·mol-1为吸热反应,温度升高,平衡正向移动,K变大;
③实验测得,v正=v(CO2)消耗=k正c(CO2),则k正=![]() ;v逆=v(CO)消耗=k逆c2 (CO),则k逆=
;v逆=v(CO)消耗=k逆c2 (CO),则k逆=![]() ;平衡时v正= v逆,则温度为T1时,k正/k逆=
;平衡时v正= v逆,则温度为T1时,k正/k逆=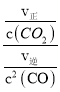 =
=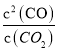 =K=
=K=![]() mol/L。
mol/L。


科目:高中化学 来源: 题型:
【题目】下列反应中的能量转化不正确的是( )
选项 | 化学反应 | 能量转化形式 |
A | CH4+2O2 | 化学能转化成热能 |
B | Pb+PbO2+2H2SO4 | 使用时放电,电能转化成化学能 |
C | mH2O+nCO2 | 光能转化成化学能 |
D | CaCO3 | 热能转化成化学能 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的江苏民歌。茉莉花香气的成分有多种,乙酸苯甲酯是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成。一种合成路线如下:
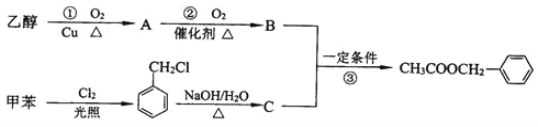
(1)A的名称为___;C的结构简式为___;
(2)写出反应①的化学方程式___;
(3)反应③的反应类型为___;
(4)C通常有三种不同类别的芳香族同分异构体,试写出另两种不同类别的同分异构体的结构简式(各写一种)___;___。
(5)反应__(填序号)原子的理论利用率为100%,符合绿色化学的。
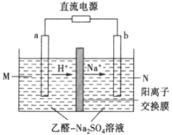
(6)一种处理高浓度乙醛废水的方法——隔膜电解法,其原理如图所示,电解质溶液为一定浓度含乙醛的Na2SO4溶液,电解后乙醛在两个电极分別转化为乙醇和乙酸。写出阳极电极式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是

选项 | ①试剂 | ①中现象 | 解释 |
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性: H2SO3 >H2SiO3 |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成 白色BaSO3沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
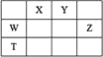
A.T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和![]()
B.由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C.W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D.X的氢化物分子中所有原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对如图所示的实验室制取氨气,下列说法正确的是
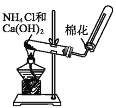
A.发生装置与用 KClO3 制取O2 的装置相同
B.可以用碱石灰或无水氯化钙干燥制得的氨气
C.可用单孔橡皮塞代替棉花
D.所用的铵盐可以是 NH4NO3,所用的碱也可以是 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
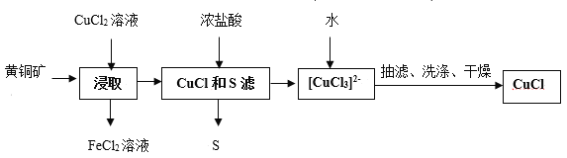
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)(无色溶液)
[CuCl3]2-(aq)(无色溶液)
下列叙述错误的是( )
A.浸取中的主要反应为CuFeS2+3CuCl2=4CuCl+FeCl2+2S
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s)+2Cl(aq)-![]() [CuCl3]2-(aq)平衡逆向移动,析出CuCl
[CuCl3]2-(aq)平衡逆向移动,析出CuCl
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的是
A.甲烷、CO合成乙酸乙酯:2CH4+2CO![]() CH3COOCH2CH3
CH3COOCH2CH3
B.烯烃与水煤气发生的羰基合成反应:RCH═CH2+CO+H2![]() RCH2CH2CHO
RCH2CH2CHO
C.葡萄糖在酒化酶作用下转化为酒精:C6H12O6![]() 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
D.工业制取乙醛的方法之一:CH≡CH+H2O![]() CH3CHO
CH3CHO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>苯
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 等质量的物质燃烧耗O2量:苯>乙烷>乙烯>甲烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com