
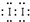 ,故答案为:Fe(SCN)3;
,故答案为:Fe(SCN)3; ;
;  KI3”,可知KI3在常温下不稳定性,受热(或潮湿)条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3?H2O作为食盐加碘剂是不合适的,
KI3”,可知KI3在常温下不稳定性,受热(或潮湿)条件下易分解为KI和I2,KI又易被空气中的氧气氧化,I2易升华,所以KI3?H2O作为食盐加碘剂是不合适的,

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
| A、等质量的乙烷、乙烯、乙炔完全燃烧耗氧量依次减小 |
| B、直链烷烃的沸点随分子中碳原子数增多而升高,相对密度则减小 |
| C、苯分子中所有的化学键都相同 |
| D、脂肪烃只能从石油获得,芳香烃只能从煤中获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、绿色化学的核心是应用化学原理对环境污染进行治理 |
| B、水泥、玻璃、青花瓷、水晶、玛瑙、分子筛都属于硅酸盐工业产品 |
| C、“埃博拉”病毒在常温下较稳定,对热有中等度抵抗力,56℃不能完全灭活,60℃30min方能破坏其感染性,此过程主要发生了蛋白质的变性 |
| D、通入过多的空气,可以使燃料充分燃烧,同时提高热量的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电池的正极反应式为:CuO+2e-+2Li+=Li2O+Cu |
| B、常温时,在正负极间接上电流表,指针不偏转 |
| C、放电过程中,Li+向负极移动 |
| D、每转移0.1mol电子,理论上消耗1.4gLi |
查看答案和解析>>
科目:高中化学 来源: 题型:
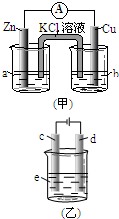 根据右图两个装置回答:
根据右图两个装置回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Si>Na>O |
| B、热稳定性:HF>HCl>H2S |
| C、碱性:CsOH>KOH>NaOH |
| D、失电子能力:K>Na>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHX的电离方程式为NaHX═Na++H++X2- |
| B、HX-的电离程度小于HX-的水解程度 |
| C、离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HX-)+c(X2-) |
| D、加水稀释,促进HX-水解,c(HX-)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com