
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体。A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系。请回答以下问题。
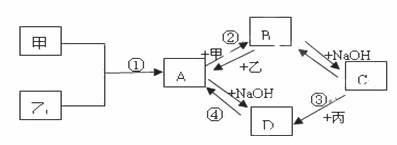
(1)气体乙是 (化学式),在其实验室制法中常用 溶液进行尾气的处理,原理用化学方程式表示为 。
(2)沉淀D是 (化学式),A→D发生的化学反应是 。
(3)写出②反应的离子方程式: 。
(4)气体丙是 (化学式),在操作③中观察到的实验现象是 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| X | Y | Z |
| 甲 | 乙 | 丙 |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年福建省漳州市高三3月质检理综化学试卷(解析版) 题型:填空题
短周期元素R、Q、M、T在元素周期表中的相对位置如下表,已知R原子最外层电子数与次外层电子数之比为2:1。
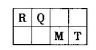
(1)人的汗液中台有T的简单离子,其离子结构示意图为_________________;元素M在元素周期表中的位置是___________________。
(2)R的最高价氧化物所含的化学键类型是__________键(选填“离子”或“共价”)。
(3)加热时,Q的最高价氧化物对应水化物的浓溶液与单质R反应的化学方程式为__________(用具体的化学式表示)。
(4)在一定条件下甲、乙、丙有如下转化:甲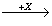 乙
乙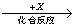 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
①R???? ②Q2?? ③M???? ④T2
(5)工业上,常利用。RO与MO2反应生成固态M单质和RO2,从而消除这两种气体对大气的污染。
已知:2RO(g)+O2(g)=2RO2(g)? △H=-akJ·mol-l
M(s)+O2(g)=MO2(g)????? △H=-bkJ·mol-l
则反应2RO(g)+MO2(g)=2RO2(g)+M(s)?? △H=___________。
(6)元素T的含氧酸HTO具有漂白性。往20mL 0.0lmol·L-l的HTO溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示。据此判断:该烧碱溶液的浓度为______________mol·L-l;下列有关说法正确的是_______________。
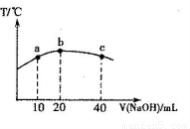
①HTO的电离常数:b点>a点
②由水电离出的c(OH—):b点<c点
③从a点到b点,混合溶液中可能存在:c(TO—)= c(Na+)
④从b点到c点,混合溶液中一直存在:c(Na+)>c(TO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014届浙江省高一下学期第一次阶段性测试化学试卷(解析版) 题型:填空题
(16分) 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语

回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为_______________________,②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是______________________。
(2)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl 3 c.Na2SO3 d.KMnO4
若已知1 克该液态化合物分解成③的单质和一种常见液体时,可放出2.9kJ能量,写出该反应的热化学方程式:
(3)工业上常采用电解A和冰晶石(Na3AlF6)混合物的方法冶炼制备⑥的单质,请从A晶体的类型和微粒间的相互作用力角度解释加冰晶石(Na3AlF6)的原因 。 并写出电解时的电极反应式: 。
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等。甲是一种极强的氧化性单质。丙与⑤的阳离子可形成一种淡黄色固体B,该固体跟水反应可得到③的单质。则B电子式 ,乙的结构式 ,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实 。(任举一例即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,它们之间的相互转化关系如下图所示(部分产物及反应条件没有列出):
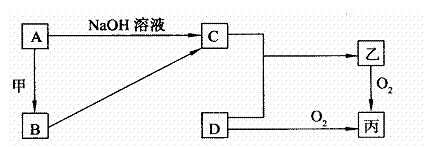
(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为 ;B在潮湿的空气中易发生电化学腐蚀,写出其发生电化学腐蚀时原电池负极的电极反应式: 。
(2)若乙在水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式 ;已知16g固体单质D完全燃烧转化成乙时,放出148.4kJ的热量,则该反应的热化学方程式为 。
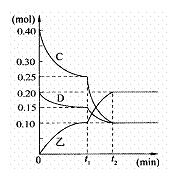
(3)若乙在水溶液呈弱碱性,并可用作农业化肥,D常况下为气体,则进行下列研究: 现将0.40 mol C和0.20 mol D充入10L的密闭容器中,在一定条件下使其发生反应,有关C、D、乙三者的物质的量的变化与时间的关系如右图所示:
①若t1 = 10min,则0至t1时间内C物质的平均反应速率为 ;该反应在t2时达到平衡,其化学反应方程式为 ,此温度下的该反应的平衡常数为 。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是 (填下列各项序号)
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com