
 已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题:
已知A、B、C、D、E、F、G是原子序数依次递增的短周期元素,已知A和D,C和F为同一主族元素,A与B、A与G形成共价化合物,B原子的最外层电子数比次外层多3,G元素的最高正化合价与最低负化合价的代数和为6,E是同周期中离子半径最小的元素,F形成的化合物是造成酸雨的主要原因.请回答下列问题: .画出G离子的结构示意图
.画出G离子的结构示意图 .
.分析 A、B、C、D、E、F、G是原子序数依次递增的短周期元素,B原子的最外层电子数比次外层多3,原子只能有2个电子层,最外层电子数为5,故B为N元素;F形成的化合物是造成酸雨的主要原因,则F为S元素;C和F为同一主族元素,则C为O元素;A、D同主族,D的原子序数大于氧,则D为Na;E、G处于第三周期,E是同周期中离子半径最小的元素,则E为Al,G元素的最高正化合价与最低负化合价的代数和为6,最外层电子数为7,则E为Cl;A与B、A与G形成共价化合物,则A为H元素.
(1)七种元素中,非金属性最强的元素为Cl;
(2)由C、D形成的一种淡黄色固体为Na2O2,由钠离子与过氧根离子构成,G离子为S2-,离子核外有18故电子,有3个电子层,构成电子数为2、8、8;
(3)G元素的单质为氯气,D的最高价氧化物对应的水化物为NaOH,二者反应生成氯化钠、次氯酸钠与水;
(4)等体积等浓度的硫酸和NaOH溶液,H2SO4、NaOH物质的量相等,金属Al足量,H2SO4、NaOH完全反应,根据方程式计算生成氢气体积之比;
(5)由H、N、O所形成的常见离子化合物是NH4NO3,该化合物与NaOH的浓溶液加热时生成硝酸钠、氨气与水;
(6)已知一包白色晶体的混合物,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
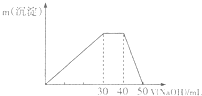
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀,则含有SO42-,白色沉淀为BaSO4,其物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,则溶液中n(SO42-)=n(BaSO4)=0.02mol;
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,开始生成沉淀,最终沉淀完全溶解,则含有Al3+,30mL~40mL时氢氧化铝质量不变,则溶液中还含有NH4+,由Al3++3OH-=Al(OH)3↓可知溶液中n(Al3+)=0.03L×1mol/L×$\frac{1}{3}$=0.01mol,由NH4++OH-=NH3.H2O可知溶液中n(NH4+)=0.01L×1mol/L=0.01mol,符合2n(SO42-)=3n(Al3+)+n(NH4+),溶液为硫酸铵、硫酸铝混合溶液,由于m(SO42-)+m(Al3+)+m(NH4+)=0.02mol×96g/mol/L+0.01mol×27g/mol+0.01mol×18g/mol=2.37g,等于样品的质量,故该晶体不含结晶水,应是硫酸铵、硫酸铝混合物,根据n(Al3+)、n(NH4+)确定比例关系.
解答 解:A、B、C、D、E、F、G是原子序数依次递增的短周期元素,B原子的最外层电子数比次外层多3,原子只能有2个电子层,最外层电子数为5,故B为N元素;F形成的化合物是造成酸雨的主要原因,则F为S元素;C和F为同一主族元素,则C为O元素;A、D同主族,D的原子序数大于氧,则D为Na;E、G处于第三周期,E是同周期中离子半径最小的元素,则E为Al,G元素的最高正化合价与最低负化合价的代数和为6,最外层电子数为7,则E为Cl;A与B、A与G形成共价化合物,则A为H元素.
(1)七种元素中,非金属性最强的元素为O,处于周期表中第二周期VIA族,故答案为:第二周期VIA族;
(2)由C、D形成的一种淡黄色固体为Na2O2,其电子式为 ,G离子为S2-,离子结构示意图为
,G离子为S2-,离子结构示意图为 ,
,
故答案为: ;
; ;
;
(3)G元素的单质为氯气,D的最高价氧化物对应的水化物为NaOH,二者反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)等体积等浓度的硫酸和NaOH溶液,H2SO4、NaOH物质的量相等,金属Al足量,H2SO4、NaOH完全反应,设H2SO4、NaOH均为3mol,由2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O=NaAlO2+3H2↑,可知生成氢气体积之比为3mol:3mol×$\frac{3}{2}$=2:3,
故答案为:2:3;
(5)由H、N、O所形成的常见离子化合物是NH4NO3,该化合物与NaOH的浓溶液加热时生成硝酸钠、氨气与水,反应离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4NO3;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(6)已知一包白色晶体的混合物,经元素分析仪分析,包含以上七种元素中的若干种,为测定其组成,进行如下实验:
①称取固体2.37g溶于水,得到无色澄清溶液,再滴加过量的氯化钡溶液和稀盐酸,得到的白色沉淀,则含有SO42-,白色沉淀为BaSO4,其物质的量为$\frac{4.66g}{233g/mol}$=0.02mol,则溶液中n(SO42-)=n(BaSO4)=0.02mol;
②再取等质量的该固体溶于水,逐滴滴加1mol/L的氢氧化钠溶液,开始生成沉淀,最终沉淀完全溶解,则含有Al3+,30mL~40mL时氢氧化铝质量不变,则溶液中还含有NH4+,由Al3++3OH-=Al(OH)3↓可知溶液中n(Al3+)=0.03L×1mol/L×$\frac{1}{3}$=0.01mol,由NH4++OH-=NH3.H2O可知溶液中n(NH4+)=0.01L×1mol/L=0.01mol,符合2n(SO42-)=3n(Al3+)+n(NH4+),溶液为硫酸铵、硫酸铝混合溶液,由于m(SO42-)+m(Al3+)+m(NH4+)=0.02mol×96g/mol/L+0.01mol×27g/mol+0.01mol×18g/mol=2.37g,等于样品的质量,故该晶体不含结晶水,应是硫酸铵、硫酸铝混合物,n(Al3+):n(NH4+)=0.01mol:0.01mol=1:1,故该混合物为:物质的量1:1的(NH4)2SO4、Al2(SO4)3混合物,
故答案为:(NH4)2SO4、Al2(SO4)3.
点评 本题考查结构性质位置关系应用、无机物推断等,侧重考查学生分析推理能力、知识迁移运用能力,(6)中关键是根据反应图象判断溶液中含有的离子,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应 | B. | 灼热的碳与CO2的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 乙烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和  | |
| B. | CH3CH2CHBrCH2Br 和CH3CHBrCH2Br | |
| C. | 苯与溴苯 | |
| D. | CH2=CH-CH=CH2和CH3-CH2-CH2-C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于实验室制备NO气体 | |
| B. | 装置②可用于模拟海水蒸馏 | |
| C. | 装置③可用于探究碳酸氢钠的热稳定性 | |
| D. | 装置④为配制溶液过程中的定容操作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg | B. | Fe | C. | Zn | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①②④ | C. | ①③⑤⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为8、中子数为10的氧原子:${\;}_{8}^{18}$O | |
| B. | 氧原子的结构示意图: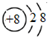 | |
| C. | 水分子的电子式: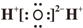 | |
| D. | 乙酸甲酯的结构简式HCOOC2H5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com