
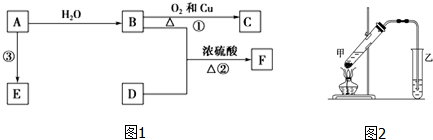
 ,B中决定其性质的重要官能团的名称为羟基.
,B中决定其性质的重要官能团的名称为羟基.分析 A的产量通常用来衡量一个国家石油化工水平,则A是CH2=CH2,乙烯和水发生加成反应生成B为CH3CH2OH,乙醇发生氧化反应生成C为CH3CHO,F是一种有香味的物质,D是生活中常见的有机物,F中碳原子数是D的两倍,可推知D为CH3COOH,乙酸与乙醇发生酯化反应生成F为CH3COOCH2CH3,乙烯发生加聚反应生成高分子化合物E为 ,据此解答.
,据此解答.
解答 解:A的产量通常用来衡量一个国家石油化工水平,则A是CH2=CH2,乙烯和水发生加成反应生成B为CH3CH2OH,乙醇发生氧化反应生成C为CH3CHO,F是一种有香味的物质,D是生活中常见的有机物,F中碳原子数是D的两倍,可推知D为CH3COOH,乙酸与乙醇发生酯化反应生成F为CH3COOCH2CH3,乙烯发生加聚反应生成高分子化合物E为 .
.
(1)A是CH2=CH2,结构式为 ,B为CH3CH2OH,决定性质的重要官能团的名称为羟基,
,B为CH3CH2OH,决定性质的重要官能团的名称为羟基,
故答案为: ;羟基;
;羟基;
(2)反应①的化学方程式为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,属于氧化反应;
反应②的化学方程式为:CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,属于酯化反应或取代反应,
故答案为:2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O;氧化反应;CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应或取代反应;
(3)鉴别乙醇与乙酸的方法为:取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇,
故答案为:取某一待测液于试管中,滴加少量石蕊溶液,若溶液变红,则所取待测液为乙酸,余下一种为乙醇;
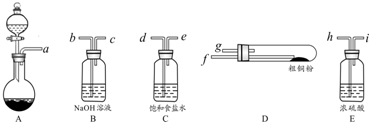
(4)在实验室里用如图2所示的装置来制取乙酸乙酯,乙中所盛的试剂为饱和碳酸钠溶液,该溶液的主要作用是与挥发出来的乙酸反应,便于闻乙酸乙酯的香味、溶解挥发出来的乙醇、降低乙酸乙酯在水中的溶解度,便于分层析出,图中导气管的出口伸入到了液面以下,会导致倒吸,
故答案为:饱和碳酸钠溶液;与挥发出来的乙酸反应,便于闻乙酸乙酯的香味、溶解挥发出来的乙醇、降低乙酸乙酯在水中的溶解度,便于分层析出;导气管的出口伸入到了液面以下.
点评 本题考查无机物推断、乙酸乙酯制备,涉及烯烃、醇、醛、羧酸的性质与转化,比较基础,侧重对基础知识的巩固.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
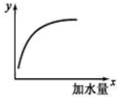 如图表示 25℃时,向 1L,0.1mol•L-1的一元弱酸HA中加水稀释过程的变化图象,则图中纵坐标y表示的是( )
如图表示 25℃时,向 1L,0.1mol•L-1的一元弱酸HA中加水稀释过程的变化图象,则图中纵坐标y表示的是( )| A. | c(H+)或 c(OH-) | B. | HA的电离平衡常数Ka | ||
| C. | c(H+)/c(HA) | D. | n(H+)或 n(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=-57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$ O2 (g)═8CO2 (g)+9H2O(g)△H=-5518 kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)═16CO2 (g)+18H2O(1)△H=-5518 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
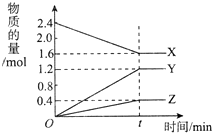 在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示.反应在t时刻达到平衡,据图回答下列问题:
在2L容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示.反应在t时刻达到平衡,据图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
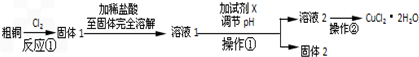
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4mol•L-1 | B. | 1.2mol•L-1 | C. | 1.1mol•L-1 | D. | 1.0mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
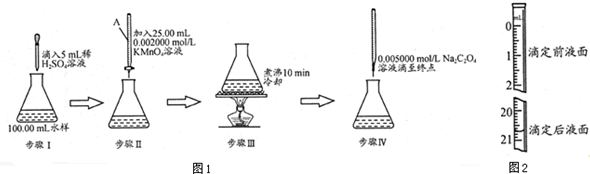
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com