
| ʵ�� | ���� | |
| A�� | ����ϩͨ��������Ȼ�̼��Һ����Һ���ձ�Ϊ��ɫ�� | ���ɵ�1��2-����������ɫ�����������Ȼ�̼ |
| B�� | �Ҵ���ˮ����������Ʒ�Ӧ������ȼ������ | �Ҵ������е�����ˮ�����е��������ͬ�Ļ��� |
| C�� | ���������ˮ���е�ˮ�����ɽ������ | ���������С��̼������� |
| D�� | �����������ڹ����·�Ӧ��Ļ��������ʹʪ���ʯ����ֽ��� | ���ɵ��ȼ���������� |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A������ϩͨ��������Ȼ�̼��Һ�������ӳɷ�Ӧ����1��2-�������飻
B���Ҵ��Ľṹ��ʽΪCH3CH2OH��ֻ���ǻ������Ʒ�Ӧ��
C�����������ˮ���е�ˮ�����ɽ��������˵���������̼��Ƶȷ�Ӧ��
D��ʹʪ���ʯ����ֽ��������ΪHCl��
��� �⣺A����ϩ����̼̼˫��������������Ȼ�̼��Һ�����ӳɷ�Ӧ������1��2-�������飬��Һ���ձ�Ϊ��ɫ������A��ȷ��
B���Ҵ��Ľṹ��ʽΪCH3CH2OH��ֻ���ǻ������Ʒ�Ӧ����-OH��H�Ļ��Ա�ˮ������B����
C�����������ˮ���е�ˮ�����ɽ��������˵���������̼��Ƶȷ�Ӧ����ǿ���Ʊ�����ĽǶ��жϣ���������Դ���̼�ᣬ��C����
D�������������ڹ��������·�Ӧ���ɵ�������һ�ȼ�����Ȼ��⣬ʹʪ���ʯ����ֽ��������Ϊ�Ȼ��⣬һ�ȼ���Ϊ�ǵ���ʣ����ܵ��룬��D����
��ѡA��
���� �����ۺϿ��黯ѧʵ�鷽�������ۣ����ؿ����л�������ʣ�����������ѧ���ķ���������ʵ��������ע������л���Ĺ����ŵ������Լ���Ӧ��������жϣ��ѶȲ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 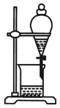 ������ͺ�ˮ | B�� | 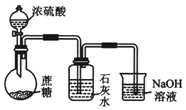 ����������Ũ���ᷴӦ������CO2 | ||
| C�� | 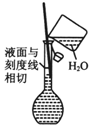 ������Һ | D�� | 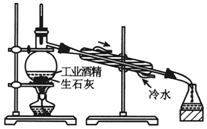 �ù�ҵ�ƾ���ȡ��ˮ�ƾ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H+��S2O32-��SO42-��Na+ �ܴ���������ͬһ��Һ�� | |
| B�� | �����£�$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1��10-12����Һ��Ba2+��Na+��ClO-��NO3-�ܴ������� | |
| C�� | �ں�1mol FeI2����Һ�У�ͨ��1mol Cl2���������ӷ�ӦΪ��2Fe2++2I-+2Cl2�T2Fe3++4Cl-+I2 | |
| D�� | ��NH4HSO4��Һ�еμ�����Ba��OH��2��Һ��NH4++H++SO42-+Ba2++2OH-�TBaSO4��+NH3•H2O+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������Ʊ��մ� | B�� | �����ڸ�������� | ||
| C�� | ��H+�����ײ���CO2 | D�� | ���ñ���ʳ��ˮ��CO2��Ӧ�Ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 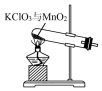 ��ȡ���� | B�� | 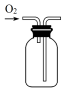 �ռ����� | C�� | 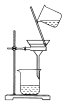 �����MnO2 | D�� |  �����ᾧ��KCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| Ŀ�� | ���� | |
| A�� | ȡ20.00 mL���� | ��50 mL��ʽ�ζ�����װ�����ᣬ������ʼ����Ϊ30.00mL��ʣ�����������ƿ |
| B�� | ��ϴ������ʵ�������Թ� | ���þƾ���ϴ������ˮ��ϴ |
| C�� | �ⶨ��������ҺpH | �ò�����պȡ��Һ������ʪ���pH��ֽ�� |
| D�� | ����Ũ��Ϊ0.010 mol•L��KMnO4��Һ | ��ȡKMnO4����0.158 g������100 mL����ƿ�У���ˮ�ܽⲢϡ�����̶� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڱ�״���£�VL��̬ϩ����CnH2n����̼̼˫������ĿΪ$\frac{V}{22.4}$ NA | |
| B�� | ��8.4 g NaHCO3�����У�����������ĿΪ0.3NA | |
| C�� | 5.6g������ϡ���ᷴӦ��ת�Ƶĵ�������0.3 NA | |
| D�� | �ڷ�ˮ�еμӺ�0.1 molFe3+��FeCl3������Һ���õ���Fe��OH��3������Ϊ0.1NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
 ����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ���ǣ�������
����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ���ǣ�������| A�� | Ts�ǵ������ڵڢ�A��Ԫ�� | |
| B�� | Ts��ͬλ��ԭ�Ӿ�����ͬ�ĵ����� | |
| C�� | Ts��ͬ��Ԫ���зǽ��������� | |
| D�� | ������Ϊ176��Ts���ط�����${\;}_{117}^{176}$Ts |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
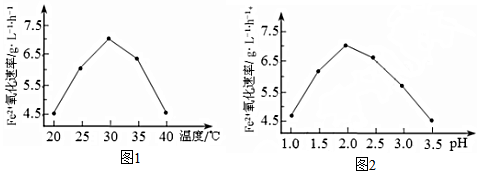
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com