
| A、量筒 | B、容量瓶 |
| C、滴定管 | D、以上均不对 |
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前滴定管中无气泡,滴定后产生气泡 |
| B、碱式滴定管量取NaOH溶液时,未进行润洗操作 |
| C、滴定时达到滴定终点时仰视读数 |
| D、锥形瓶盛装NaOH待测液前加少量水洗涤 |
查看答案和解析>>
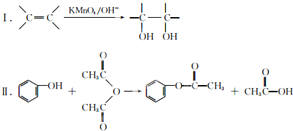
科目:高中化学 来源: 题型:
| 滴定次数 | 待测氢氧化钠 的体积/ml | 0.1000mol?L-1盐酸的体积/ml | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/ml | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 34.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
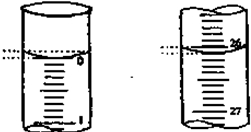
科目:高中化学 来源: 题型:
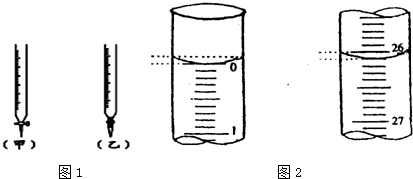
| 锥形瓶中溶液 | 滴定管中溶液 | 指示剂 | 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 石蕊 | (乙) |
查看答案和解析>>
科目:高中化学 来源: 题型:
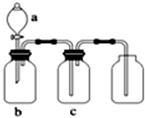 如图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( )
如图装置可用于制取、并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂)其中可行的是( ) | 选项 | 气体 | a | b | c |
| A | 二氧化氮 | 浓硝酸 | 铜片 | 氢氧化钠溶液 |
| B | 二氧化硫 | 浓硫酸 | 铜片 | 酸性高锰酸钾溶液 |
| C | 氨 | 浓氨水 | 生石灰 | 碱石灰 |
| D | 二氧化碳 | 稀盐酸 | 碳酸钙 | 浓硫酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH=5的硫酸溶液稀释1000倍后,溶液中的SO42-与H+浓度的比值约为1:20 |
| B、0.1 mol/L NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2 c(CO32-) |
| C、将0.2 mol/L NaA溶液和0.1 mol/L盐酸溶液等体积混合所得溶液显碱性且有:c(Na+)+c(H+)=c(A-)+c(Cl-) |
| D、pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,由水电离出来的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com