

| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑池 | 无现籴 |
| 0.02mol•L-1 | 少许浑油 | 尤现象 | 尤现象 |
分析 (1)盐酸与碳酸钙反应生成二氧化碳气体和氯化钙,其中盐酸易挥发,据此选择仪器;
(2)①饱和澄清石灰水与碳酸钠和碳酸氢钠均能反应生成碳酸钙沉淀,据此解答;
②(i)计算此时溶液中钡离子浓度与碳酸根浓度的乘积与该温度下碳酸钡的溶度积常数比较即可;
(ii)钡离子与碳酸氢根离子反应生成二氧化碳和碳酸钡沉淀;
③取用实验室中分析纯与样品进行pH的测算比较即可;
④发生2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,由图中所给数据可知在180℃时,固体的残留率为63.09%,根据方程式计算100g固体完全分解时剩余固体的质量,据此分析.
解答 解:(1)C为发生装置,盐酸与碳酸钙反应生成二氧化碳气体和氯化钙,其中盐酸易挥发,故应先选取碳酸氢钠除去混合气体中的HCl,故仪器连接顺序为:CAB,
故答案为:CAB;
(2)①饱和澄清石灰水与碳酸钠和碳酸氢钠均能反应生成碳酸钙沉淀,故甲方案不可行,
故答案为:不可行;
②(i)两种溶液等体积混合后,溶液中钡离子浓度=$\frac{0.2mol/L}{2}$=0.1mol/L,0.1 mol•L-1 NaHC03溶液电离出的c(CO32-)为0.0011 mol•L-1,故Q=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9,故会产生沉淀,
故答案为:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9;
(ii)钡离子与碳酸氢钠电离出的碳酸根结合生成碳酸钡沉淀,从而促进了碳酸氢根的电离,使其向生成碳酸根和氢离子的方向移动,故离子反应方程式为:Ba2++2HCO3-=BaCO3↓+CO2↑+H2O,
故答案为:Ba2++2HCO3-=BaCO3↓+CO2↑+H2O;
③丙方案为测定pH法,由于碳酸氢钠属于强碱弱酸盐,溶于水中配成V mL的溶液,利用准确度较高的pH计进行样品的pH值,然后测量等质量等浓度的分析纯NaHC03的pH值,最后比较即可,
故答案为:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH;
④发生反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,由图中所给数据可知在180℃时,固体的残留率为63.09%,
设碳酸氢钠为100g,
则2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
168 106
100g xg
解得:x=63.09g,
即理论上碳酸氢钠每有100g分解应生成63.09g固体,
故由图可知100g样品分解恰好生成固体为63.09g,故此样品只含有为NaHCO3,
故答案为:制得的固体样品是纯净的NaHCO3.
点评 本题考查了制备方案的设计、碳酸氢钠的性质、Ksp的有关计算等知识,题目难度较大,熟练掌握碳酸氢钠的性质以及其热分解原理是解决本题的关键,试题侧重考查学生的分析、理解能力及化学实验能力.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
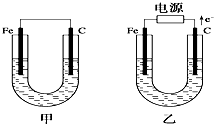 如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1 | |
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移电子3.2 mol | |
| C. | 若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移电子3.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.04 | B. | 0.04mol/(L.s) | C. | 0.08mol(L.s) | D. | 0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com