
| A. | 若XY3分子中X原子处于正三角形的中心,则XY3分子为非极性分子 | |
| B. | C2H5OH与C2H5Br相比,前者的沸点远高于后者,其原因是前者的分子间存在氢键 | |
| C. | 同周期ⅠA族元素和ⅦA族元素之间只能形成离子化合物 | |
| D. | 由两种非金属元素组成的化合物分子中只可能有极性键,不会有非极性键 |
分析 A、若XY3分子中X原子处于正三角形的中心,则正负电荷中心重合;
B、分子间存在氢键使物质的熔沸点异常的高;
C、与ⅦA族元素同周期的第IA族元素全部为活泼金属元素;
D、两种非金属元素组成的化合物分子中,若同种元素之间存在化学键,则为非极性键.
解答 解:A、若XY3分子中X原子处于正三角形的中心,则正负电荷中心重合,所以XY3分子为非极性分子,故A正确;
B、分子间存在氢键使物质的熔沸点异常的高,而C2H5OH分子间存在氢键,所以C2H5OH的沸点比C2H5Br高,故B正确;
C、与ⅦA族元素同周期的第IA族元素全部为活泼金属元素,活泼金属与活泼非金属元素之间新城离子键,形成的化合物为离子化合物,故C正确;
D、两种非金属元素组成的化合物分子中,若同种元素之间存在化学键,则为非极性键,如H2O2中存在O-O非极性键,故D错误.
故选D.
点评 本题考查分子的极性、键的极性、离子化合物、氢键等,题目涉及的知识点较多,侧重于基础知识的考查,题目比较容易.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
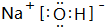 ,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.
,F溶液与足量EDA的稀溶液混合,其离子方程式为:NH4++HCO3-+OH-=NH3.H2O+2CO32-+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2,n=4 | B. | m=0.5,n=4 | C. | m=2,n=0.25 | D. | m=0.5,n=0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | A | B | C | D | E |
| 性质 或结 构信 息 | 室温下单质呈气态,原子最外层电子数与D相同 | D3B中阳离子与阴离子的电子层结构相同 | A和C可形成两种常见的化合物甲和乙,甲有强氧化性 | 单质质软、银白色固体、导电性强,在空气中燃烧生成淡黄色固体 | E的气态氢化物和最高价氧化物对应的水化物均为强酸,C、D和E三种元素形成的一种盐丙为某消毒液的主要成分 |
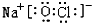 .丙在水溶液中的电离方程式NaClO=Na++ClO-.
.丙在水溶液中的电离方程式NaClO=Na++ClO-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH | B. | H2SO4 | C. | HClO4 | D. | MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,该化合物属于离子化合物.
,该化合物属于离子化合物.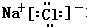 、
、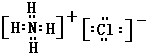 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com