
组别 | 锌的质量/g | 锌的形状 | 温度/℃ | 溶解于酸所需的时间/s |
第一组 | 2 | 薄片 | 5 | 400 |
第二组 | 2 | 薄片 | 15 | 200 |
第三组 | 2 | 薄片 | 25 | 100 |
第四组 | 2 | 薄片 | 35 | 40 |
第五组 | 2 | 薄片 | 45 | 25 |
第六组 | 2 | 粉末 | 15 | 5 |
试求:
(1)画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
(2)利用所画的曲线图,关于温度影响反应速率你能得出什么结论?
(3)20 ℃时,2 g锌片溶解于酸中需多少时间?
(4)对比第二组与第六组实验,解释第六组实验反应为什么那么快。
科目:高中化学 来源: 题型:
| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
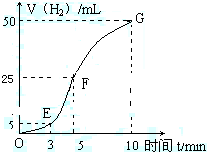 某课外兴趣小组欲探究铝与盐酸反应的能量变化以及影响化学反应速率的因素.做如下实验,请填写下列空白:
某课外兴趣小组欲探究铝与盐酸反应的能量变化以及影响化学反应速率的因素.做如下实验,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
| 锌的质量/g | 锌的形状 | 温度/℃ | 溶解于酸所需的时间/s |
第一组 | 2 | 薄片 | 5 | 400 |
第二组 | 2 | 薄片 | 15 | 200 |
第三组 | 2 | 薄片 | 25 | 100 |
第四组 | 2 | 薄片 | 35 | 40 |
第五组 | 2 | 薄片 | 45 | 25 |
第六组 | 2 | 粉末 | 15 | 5 |
试求:(1)画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
(2)利用所画的曲线图,关于温度影响反应速率你能得出什么结论?
(3)20 ℃时,2 g锌片溶解于酸中需多少时间?
(4)对比结果第二组与第六组, 第六组为什么那么快?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com