
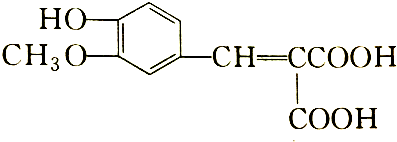
 含有的官能团有( )
含有的官能团有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
科目:高中化学 来源: 题型:选择题
| A. | 向稀盐酸中加NaNO3溶液 | B. | 向稀盐酸中加碳酸钠固体 | ||
| C. | 将锌粒制成薄片 | D. | 向稀盐酸中加食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )
某分子的球棍模型如图所示.已知分子中所有原子的最外层均达到 8 电子稳定结构,原子间以单键相连.下列有关说法中一定错误的是( )| A. | X原子可能为第VA族元素 | |
| B. | 该分子中既含有极性共价键又含有非极性共价键 | |
| C. | Y 原子可能为第ⅠA 族或第ⅦA 族元素元素 | |
| D. | 从圆球的大小分析,该分子可能为 N2F4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
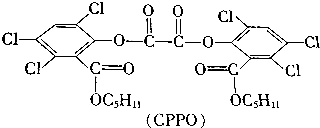
| A. | 32种 | B. | 36种 | C. | 64种 | D. | 72种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
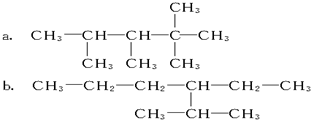
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com