
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.4 mo l•L-1 NaOH溶液 | B. | 5 mL 0.3 mo l•L-1 Na3PO4溶液 | ||
| C. | 10 mL 0.3 mo l•L-1 Na2SO4溶液 | D. | 5 mL 0.5 mol•L-1 NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
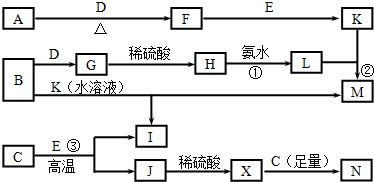
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
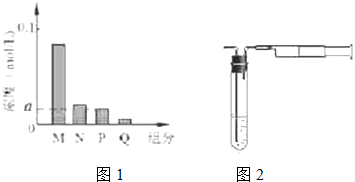 已知X、Y是两种性质相似的短周期元素.
已知X、Y是两种性质相似的短周期元素. ,它们的单质都必须采用电解法制备,但都无需密封保存,
,它们的单质都必须采用电解法制备,但都无需密封保存, .(2)Y元素在周期表中位置第三周期ⅢA族.
.(2)Y元素在周期表中位置第三周期ⅢA族. ,X是形成化合物种类最多的元素.
,X是形成化合物种类最多的元素. ,X、Y的最高价含氧酸的浓溶液都有强氧化性.
,X、Y的最高价含氧酸的浓溶液都有强氧化性.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都是酸性氧化物,故均不与酸反应 | |
| B. | 两者都可以与NaOH溶液反应 | |
| C. | CO2 的溶沸点比SiO2高 | |
| D. | 两者都能与水反应生成对应的酸且碳酸的酸性大于硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试剂 | 离子反应方程式 | |
| ①Mg(Al) | ||
| ②FeCl2溶液(FeCl3) | ||
| ③NaHCO3(Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-、Cl-、K+ | B. | Cl-、Br-、I- | C. | Na+、Mg2+、Cl- | D. | O2-、Mg2+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com