
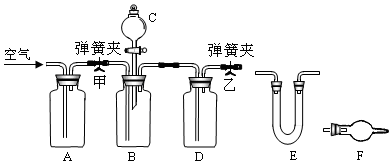
分析 依据实验步骤⑤是需要关闭甲打开乙B中稀硫酸和样品反应生成二氧化碳气体;
⑥反应完全后,需要打开甲乙,把装置中生成的二氧化碳全部赶入E装置吸收;
(1)装置D中需要用浓硫酸干燥二氧化碳气体减少实验误差,装置C是稀硫酸,目的是和样品中碳酸钠反应生成二氧化碳气体;
(2)实验过程中,先、后共两次鼓入空气,第二次鼓入空气的目的是把生成的二氧化碳全部赶出吸收减少实验误差;
(3)E装置连接F可以避免空气中的二氧化碳水蒸气被E吸收产生误差;
解答 解:⑤依据实验步骤⑤是需要关闭甲打开乙B中稀硫酸和样品反应生成二氧化碳气体;
故答案为:关闭弹簧夹甲,打开乙,将稀H2SO4滴加到装有试样的试剂瓶中;
⑥反应完全后,需要打开甲乙,把装置中生成的二氧化碳全部赶入E装置吸收;
故答案为:反应完全后,打开弹簧夹甲和乙,用气卿鼓气一段时间;
(1)装置D中需要用浓硫酸干燥二氧化碳气体减少实验误差,装置C是稀硫酸,目的是和样品中碳酸钠反应生成二氧化碳气体;
故答案为:吸收CO2中的H2O,⑨;
(2)实验过程中,先、后共两次鼓入空气,第二次鼓入空气的目的是把生成的二氧化碳全部赶出吸收减少实验误差;
故答案为:驱赶残留在装置中的CO2,以使其完全被吸收;
(3)在E装置后应再连接F装置,可以利用碱石灰吸收水蒸气和二氧化碳,避免空气中的水蒸气和二氧化碳被E吸收产生误差;
故答案为:必要;
点评 本题考查了探究物质性质的实验设计和实验验证方法的分析判断,掌握实验基础和物质性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的NaClO溶液中所含ClO-的数目为NA | |
| B. | 标准状况下,2.24 L乙醇中含有的C-H数目为0.5NA | |
| C. | 常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA | |
| D. | 2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬脂酸甘油酯在NaOH溶液中水解完全后,加入饱和食盐水,下层析出硬脂酸钠 | |
| B. | 天然高分子化合物淀粉或纤维素最终的水解产物都是葡萄糖 | |
| C. | 鸡蛋清的溶液中加入福尔马林溶液,鸡蛋清凝聚,蛋白质变性 | |
| D. | 不同种类的氨基酸能以不同的数目和顺序彼此结合,形成更复杂的多肽化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
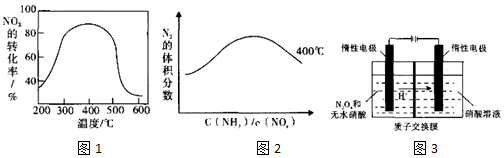
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应生成了1.12L(标准状况)H2 | |
| B. | 向反应后的溶液中加入足量小苏打,最终有白色沉淀生成 | |
| C. | 在反应后的溶液中一定能大量共存的粒子有:K+、Mg2+、I-、NO3- | |
| D. | 向反应后的溶液中加入足量稀硫酸,最终有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
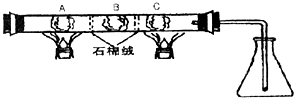 在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
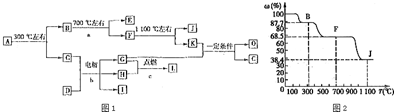
 .
.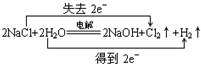 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com