
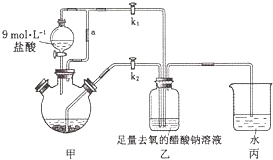
分析 装置甲:分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl═ZnCl2+H2↑,同时发生2CrCl3+Zn═2CrCl2+ZnCl2,生成氢气,用来增大压强把生成的CrCl2溶液压入装置乙中;装置乙:2Cr2++4CH3COO-+2H2O═[Cr(CH3COO)2]2•2H2O↓,装置丙是保持装置压强平衡,同时避免空气进入.
(1)连通管a利用的是连通器原理,可以使容器内和漏斗上方压强相等;
(2)根据三颈烧瓶中发生的反应的目的是得到Cr2+,这是利用Zn的还原性,据此书写反应方程式;
(3)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开K2关闭K1,把生成的CrCl2溶液压入装置3中反应;
(4)装置丙中导管口水封的目的是避免空气进入;
(5)醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,据此选择洗涤试剂;
(6)CrCl3为0.02mol,得到CrCl2为0.02mol,由原子守恒,根据CrCl2计算[Cr(CH3COO)2]2•2H2O 的理论产量,进而计算其产率;
(7)欲验证混合气体中有CO和CO2,可以结合两气体的性质进行检验,其中CO2能使澄清石灰水变浑浊,而CO有还原性.
解答 解:(1)连通管a使容器内和漏斗上方压强相等,有利于漏斗内的液体顺利滴下,故答案为:使漏斗内的液体顺利滴下;
(2)装置甲:分液漏斗盛装稀盐酸,在圆底烧瓶中和锌反应Zn+2HCl═ZnCl2+H2↑,同时发生2CrCl3+Zn═2CrCl2+ZnCl2,该反应的离子反应为:2Cr3++Zn═2Cr2++Zn2+,
故答案为:2Cr3++Zn═2Cr2++Zn2+;
(3)实验开始生成H2气后,为使生成的CrCl2溶液与CH3COONa溶液顺利混合,打开K2关闭K1,把生成的CrCl2溶液压入装置乙中反应,
故答案为:打开K2关闭K1;
(4)二价铬不稳定,极易被氧气氧化,装置丙中导管口水封的目的是避免空气进入装置乙氧化二价铬,
故答案为:避免空气进入装置乙氧化二价铬;
(5)醋酸亚铬水合物不溶于冷水和醚,微溶于醇,易溶于盐酸,所以可以选用冷水和乙醚洗涤[Cr(CH3COO)2)]2•2H2O产品,最后再用乙醚洗涤干燥,故答案为:b、c、a;
(6)CrCl3为$\frac{3.17g}{158.5g/mol}$=0.02mol,得到CrCl2为0.02mol,根据原子守恒,则得到[Cr(CH3COO)2]2•2H2O为0.02mol,质量为0.02mol×$\frac{1}{2}$×376g/mol=3.76g,所得产品的产率为$\frac{2.76g}{3.76g}×100%$=73.4%,故答案为:74.3%;
(7)将受热得到的混合气体通入澄清石灰水中,变浑浊,说明混合气体中含有CO2,或将混合气体通入灼热的CuO,固体颜色由黑色变红色,说明混合气体中有CO,故答案为:①混合气体通入澄清石灰水中,变浑浊,说明混合气体中含有CO2;
②混合气体通入灼热的CuO,固体颜色由黑色变红色,说明混合气体中有CO.
点评 本题考查物质制备实验,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等,注意对题目信息的应用,有利于培养学生分析能力、实验能力,题目难度中等.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:选择题
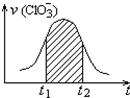 氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )
氯酸钾和亚硫酸氢钾能发生氧化还原反应:ClO3-+3HSO3-=3SO42-+Cl-+3H+,已知该反应的速率随溶液酸性的增强而加快.如图为用ClO3-在单位时间内的物质的量浓度的变化来表示该反应速率的速率-时间图象.下列说法不正确的是( )| A. | 反应开始时速率增大可能是c(H+)增大引起的 | |
| B. | 纵坐标为v(H+)的速率-时间曲线与图中曲线不能完全重合 | |
| C. | 后期反应速率下降的主要原因是反应物浓度减小 | |
| D. | 图中阴影部分“面积”为t1至t2时间内的ClO3-的物质的量的减小值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
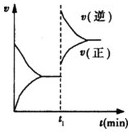
| A. | t1时,一定是缩小了容器的体积 | |
| B. | t1时,可能是向容器中通入了一定量的C气体 | |
| C. | t1时改变外界条件后,该反应的平衡常数可能减小,也可能不变 | |
| D. | t1时,可能是向容器中加入了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
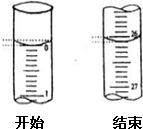 某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL)] | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | |||
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 氢键X-H…Y | 键能kJ.mol-1 |
| (HF)n | D-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
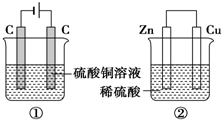 如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置,工作时转移的电子数相等,反应完成后往①中加入9.8gCu(OH)2固体,溶液恰好能回复原浓度和体积.若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阴极:Cu2++2e-═Cu②中正极:2H++2e-═H2↑ | |
| D. | 反应完成后溶液PH:①<7,②>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验装置 | 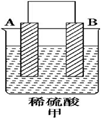 |  | 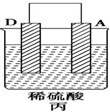 |
| 部分实验现象 | A(二价金属)不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com