
短周期主族元素W、R、X、Y、Z,原子序数依次增大。W、X、Y三种元素原子的最外层电子数之和为15,Y原子核电荷数等于W原子核电荷数的2倍,R原子最外层电子数与X原子最外层电子数相差1。下列叙述正确的是
A、R在化合物中显+1价
B、最高价氧化物的水化物的碱性:X>R
C、原子半径:X>Y>Z
D、简单气态氢化物的沸点:Y>W
 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源:2015-2016学年内蒙古包头九中高一下第一次月考化学试卷(解析版) 题型:实验题
NH3及其盐都是重要的化工原料。
(1)合成氨工业对化学的国防工业具有重要意义,写出氨的两种重要用途 。
(2)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 。
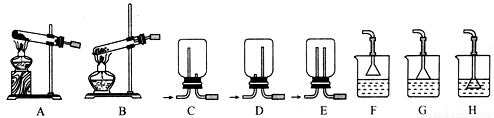
实验室制备氨气,下列方法中适宜选用的是 。
①固态氯化铵加热分解 ②固体氢氧化钠中滴加浓氨水
③氯化铵溶液与氢氧化钠溶液共热 ④加热农氨水
(3)按下图装置进行NH3性质实验。(已知AB两瓶容积相同)
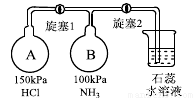
①先打开旋塞1,B瓶中的现象是 ,原因是 ,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是 。
(4)某兴趣小组在实验室探究工业合成硝酸的化学原理。
①氨的催化氧化:图a是探究氨的催化氧化的简易装置,实验中观察到锥形瓶中铂丝保持红热,有红棕色气体生成或白烟产生。白烟的成分是 (填化学式)。
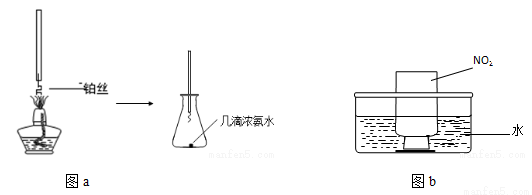
②NO2的吸收:如图b所示,将一瓶NO2倒置于水槽中,在水下移开玻璃片,可观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:填空题
某元素M的最高价氧化物为MO2,在其简单氢化物中M的质量分数为0.75。
(1)M的摩尔质量 。
(2)已知M的原子核内质子数与中子数相等,则元素M的最高价氧化物为 (填“酸性”“碱性”或“两性”)氧化物,写出MO2与过量氢氧化钠溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
下列关于化学用语的表述正确的是
A.HClO的结构式:H-Cl-O
B.纯碱的化学式为:Na2CO3
C.原子核内有8个中子的碳原子148C
D.Na2O3电子式为
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一下期中化学试卷(解析版) 题型:选择题
能够说明氯的非金属性比硫强的事实有
①HCl酸性强于H2S的酸性
②将氯气通入H2S溶液中可置换出硫
③氯气与铁反应生成FeCl3,硫与铁反应生成FeS
④硫和氯变成简单阴离子时硫原子得到的电子更多
⑤氯气和氢气的混合气,经强光照射可剧烈反应,而硫与氢气反应需较高温度
A.②③⑤ B.①③⑤ C.①②③ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一下期中化学试卷(解析版) 题型:选择题
把A、B、C、D4块金属片浸入稀硫酸中,用导线两辆相连组成原电池。若A、B相连时,A为负极;C、D相连时,D上产生大量气泡;A、C相连时,电流由C经导线流向A;B、D相连时,H+在溶液中流向B,则此4种金属的活动性由强到弱的顺序为
A.A>B>C>D B.A>C>D>B
C.C>A>B>D D.B>A>C>D
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高一下期中化学试卷(解析版) 题型:选择题
元素周期表是学习化学的重要工具,下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是
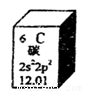
A.该元素的原子序数为6
B.该元素所有原子的质子数均为6
C.该元素的原子质量为12.01 g
D.该元素应有多种同位素,所有原子的中子数不都为6
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:选择题
某有机物的结构简式为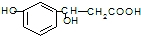 ,它可以发生反应的类型有( )
,它可以发生反应的类型有( )
①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚.
A.①②⑤⑥ B.③④⑤⑥ C.①②③④ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三高考考前模拟十二化学试卷(解析版) 题型:填空题
X、Y、Z、R、M是原子序数依次增大五种元素,基态X原子的s电子数比p电子数多3个,在周期表中Y与Z相邻且第一电离能Y>Z,Z、R同主族,M核外电子有29种运动状态,请回答下列问题:
(1)基态M2+的电子排布式为__________,X、Y、Z、M的电负性由大到小的顺序为__________。
(2)化合物XCl3的中心原子杂化类型为__________;YCl3的立体构型为__________,XCl3、YCl3分子中属于非极性分子的是__________。
(3)H2Z、H2Z2、H2R的沸点分别为100℃、158℃,-60.4℃,试解释此种现象____________。
(4)H2RO3的K1和K2分别为1.54×10-2和1.02×10-7,熔融化状态下RO3不能导电而Na2O能导电,请根据结构与性质的关系解释下列问题:
①K1>K2:____________。
②RO3不能导电而Na2O能导电:____________。
(5)Z、M形成的一种化合物晶胞如图所示: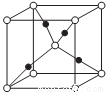 (实心球代表M)
(实心球代表M)
①该化合物的化学式为_______________。
②若晶胞参数为apm。列式计算该晶胞的密度籽=____g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com