
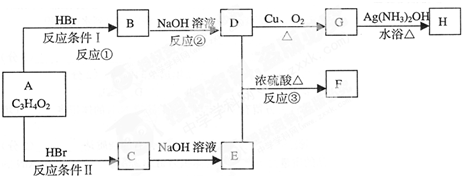
| 2×3+2-4 |
| 2 |
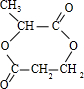 ,据此解答.
,据此解答.| 2×3+2-4 |
| 2 |
 ,
,| △ |
| △ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 组别 | 1 | 2 | 3 |
| 盐酸的体积/mL | 50 | 50 | 50 |
| 固体A的质量/g | 3.80 | 6.20 | 7.20 |
| 生成气体体积/mL | 896 | 1344 | 1344 |
查看答案和解析>>
科目:高中化学 来源: 题型:
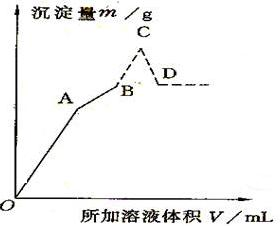
| A | B | C | D | |
| V[Ba(OH)2 (aq)]/ml | ||||
| V[HCl(aq)]/ml | ||||
| M沉淀/g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该有机物中含有碳碳双键 |
| B、该有机物属于芳香烃 |
| C、该有机物分子含有碳碳叁键 |
| D、该有机物具有三维空间的立体结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知,现使用1 mol/L KI溶液、0.1 mol/L硫酸和淀粉溶液探究溶液出现蓝色的时间与温度的关系,应先将1 mol/L KI溶液、0.1 mol/L硫酸混合,升温后再加入淀粉溶液 |
| B、将稀氯化铁溶液和稀硫氰化钾溶液混合,溶液呈浅红色,无论向其中加入浓氯化铁溶液还是浓硫氰化钾溶液,红色都会加深 |
| C、向0.1 mol/L的醋酸和饱和硼酸溶液中滴加等浓度的碳酸钠溶液,均有气体生成 |
| D、实验测定酸碱滴定曲线时.要保证整个过程测试和记录pH的间隔相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO42-和NO3-可能来自同一工厂 |
| B、Cl-和NO3-一定在相同的工厂 |
| C、Ag+和Na+可能来自同一工厂 |
| D、Na+和NO3-一定来自不同的工厂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com