
| A. | 2.3g钠由原子变成离子时,失去的电子数为0.2 NA | |
| B. | 0.2 NA个硫酸分子与19.6g磷酸(H3PO4)含有相同的氧原子数 | |
| C. | 28g氮气所含的原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为8:1 |
分析 A.钠失去电子生成Na+;
B.硫酸和磷酸摩尔质量相等,而每分子中含有氧原子数相同;
C.氮气是双原子分子;
D.NA个氧分子与NA个氢分子的质量之比等于摩尔质量之比.
解答 解:A.2.3g钠物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,由原子变成离子时,失去的电子数为0.1 NA,故A错误;
B.硫酸和磷酸摩尔质量相等,而每分子中含有氧原子数相同,19.6g磷酸分子数也为0.2NA,故B正确;
C.28g氮气是1mol,含有的原子数为2NA,故C错误;
D.NA个氧分子与NA个氢分子的质量之比等于摩尔质量之比,即32:2=16:1,故D错误;
故选:B.
点评 本题考查了阿伏伽德罗常数,完成本题需要熟练掌握有关物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数等之间的转化关系,题目难度不大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知二元酸H2A在溶液中的电离方程式为:H2A═H++HA- HA-?H++A2-,则NaHA溶液中离子浓度的关系有:c(Na+)═c(A2-)+c(HA-)+c(H2A)和c(A2-)═c(H+)-c(OH-) | |
| B. | 已知:室温时Ka(HA)=10-5.则室温时 0.1mol/LNaA溶液的pH约为10 | |
| C. | HCN溶液加水稀释的过程中$\frac{c({H}^{+})}{c(C{N}^{-})}$减小 | |
| D. | 向明矾溶液中逐滴滴入Ba(OH)2溶液至硫酸根离子刚好完全沉淀时,所得溶液中离子浓度关系有:c(K+)>c(AlO2-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取8 g NaOH固体,放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解 | |
| B. | 称取8 g NaOH固体,放入100 mL量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| C. | 称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| D. | 用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
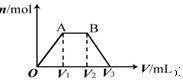 有KOH和Ca(OH)2的混合溶液,C(OH-)═0.1mol•L-1.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
有KOH和Ca(OH)2的混合溶液,C(OH-)═0.1mol•L-1.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )| A. | 560、672 | B. | 1008、1120 | C. | 2240、2352 | D. | 392、504 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. .
. .
.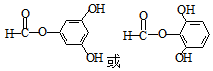 .
. )和邻二苯酚为原料(其它试剂任选),设计制备
)和邻二苯酚为原料(其它试剂任选),设计制备 的合成路线.
的合成路线.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com