
| A. | 由水电离出的c(H+)=1×10-12mol•L-1的溶液中:Na+、Cu2+、Cl-、SO${\;}_{4}^{2-}$一定能大量共存 | |
| B. | 加入金属钠有氢气产生的水溶液中:K+、Na+、HCO${\;}_{3}^{-}$、NO${\;}_{3}^{-}$四种离子一定不能大量共存 | |
| C. | 银氨溶液中加入足量的盐酸:Ag(NH3)${\;}_{2}^{+}$+OH-+3H++Cl-=H2O+AgCl↓+2NH${\;}_{4}^{+}$ | |
| D. | pH=2的氯水加水稀释10倍,稀释后的氯水的pH=3 |
分析 A.该溶液中存在大量氢离子或氢氧根离子,铜离子与氢氧根离子反应,在碱性溶液中不能大量共存;
B.钠能够与水反应,所以该溶液可能为酸性、中性或碱性溶液,四种离子之间不反应,能够存在于弱碱性溶液中;
C.盐酸足量,银氨络离子、氢氧根离子都完全反应;
D.氯水中存在氯气的溶解平衡、次氯酸的电离平衡,稀释后溶液pH变化小于1.
解答 解:A.由水电离出的c(H+)=1×10-12mol•L-1的溶液为酸性或碱性溶液,Cu2+与碱性溶液中的氢氧根离子反应,在碱性溶液中不能大量共存,故A错误;
B.加入金属钠有氢气产生的水溶液可能为酸性、中性或碱性溶液,K+、Na+、HCO3-、NO3-之间不反应,在溶液中能够大量共存,故B错误;
C.银氨溶液中加入足量的盐酸,反应生成氯化银沉淀、铵根离子和水,反应的离子方程式为:Ag(NH3)2-+OH-+3H++Cl-=H2O+AgCl↓+2NH4+,故C正确;
D.pH=2的氯水加水稀释10倍,氯气的溶解平衡向着正向移动,且次氯酸的电离程度增大,则稀释后的氯水的pH<3,故D错误;
故选C.
点评 本题考查了离子共存的判断、离子方程式的书写,为高考的高频题,题目难度中等,明确离子共存条件、离子方程式的书写原则为解答关键,试题培养了学生的分析能力及灵活应用能力.


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Si>Mg | B. | 氢元素不存在同位素 | ||
| C. | 该反应熵增 | D. | SiH4比HCl稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
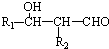
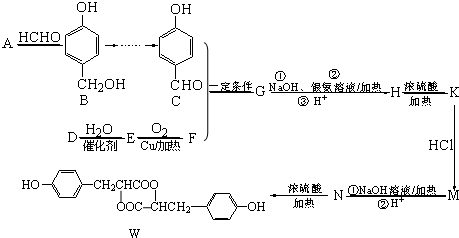
 .
.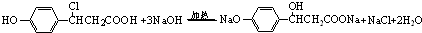 .
.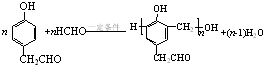 .
.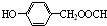 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M与R的质子数之和一定等于21 | B. | 若M在第3周期,则R一定在第2周期 | ||
| C. | M2-可能比R+的离子半径小 | D. | M与R的原子序数之差可能等于7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
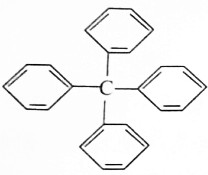 甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:
甲烷分子中的四个氢原子都可以被取代,若甲烷分子中的四个氢原子都被苯基取代得到的物质结构如图所示:| A. | 分子式为C25H20 | |
| B. | 所有碳原子都在同一平面上 | |
| C. | 此物质属于芳香烃类物质 | |
| D. | 该物质中既含有极性键又含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、NaNO3、NH4Cl | B. | K2CO3、HCl、CaCl2 | ||
| C. | Na2CO3、HNO3、HCl | D. | K2CO3、KCl、H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7的溶液 | B. | c(H+)>c(OH-) 的溶液 | ||
| C. | c(H+)=1×10-7mol•L-1 | D. | c(H+)=c(OH-) 的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com