
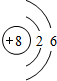 ;B为N元素,在周期表中的位置为第二周期第ⅤA族,
;B为N元素,在周期表中的位置为第二周期第ⅤA族,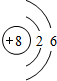 ;二、ⅤA;
;二、ⅤA;

科目:高中化学 来源: 题型:
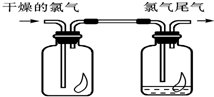 (1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是
(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现象是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
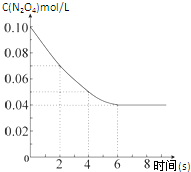 在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).
在温度为298K时,将0.10mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g)?2NO2(g)的平衡.下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间).| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
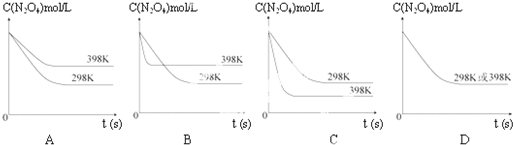
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸 | 电离常数 | 弱酸 | 电离常数 |
| H2CO3 | K1=4.4x 10-7 K2=4.7x 10-11 |
CH3COOH | K=1.75x 10-5 |
| H2SO3 | K1=1.54x 10-2 K2=1.01x 10-7 |
H2C2O4 | K1=5.4x 10-2 K2=5.4x 10-5 |
| A、上述四种酸的酸性强弱顺序为:H2C2O4>H2SO3>CH3COOH>H2CO3 |
| B、物质的量浓度相等的CH3COONa、NaHCO3两溶液中:c(CH3COO-)>c(HCO3-) |
| C、0.1mol/L NaHSO3溶液中的电荷守恒表达式:c(Na+)+c(H+)=c(HSO3-)+2 c(SO32-)+c(OH-) |
| D、0.1mol/L NaHC2O4溶液中c(Na+)、c(HC2O4-)、c(OH-)、c(H+)的大小顺序为:c(Na+)>c(HC2O4-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com