
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应。某探究小组利用反应过程中溶液紫色消失快慢的方法来研究影响反应速率的因素。
Ⅰ.实验前首先用浓度为0.1000mol•L-1酸性KMnO4标准溶液滴定未知浓度的草酸。
⑴写出滴定过程中发生反应的离子方程式为 。
⑵滴定过程中操作滴定管的图示正确的是 。

⑶若配制酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度 (填“偏高”、“偏低”、或“不变”)。
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol·L-1 。用该草酸溶液按下表进行后续实验(每次实验草酸溶液的用量均为8mL)。
| 实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究
b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影响。 |
| 体积(mL) | 浓度 (mol•L-1) | |||
| 1 | 25 | 0.5 | 4 | 0.1000 |
| 2 | 50 | 0.5 | 4 | 0.1000 |
| 3 | 25 | 0.5 | 4 | 0.0100 |
| 4 | 25 | 0 | 4 | 0.1000 |
⑷写出表中a 对应的实验目的 ;
⑸该小组同学对实验1和3分别进行了三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
分析上述数据后得出“当其它条件相同时,酸性高锰酸钾溶液的浓度越小,褪色时间就越短,即反应速率就越快”的结论。某同学认为该小组“探究反应物浓度对速率影响”的实验方案设计中存在问题,从而得到了错误的实验结论,请简述改进的实验方案_________。
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示)
为 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列实验操作中,正确的是
A、配制5%NaCl溶液时,将称量的NaCl放入烧杯中加计量的水搅拌溶解
B、配制1mol·L-1NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶
C、配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
D、取用一小块钠时,将剩余的钠丢进废液缸
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、Na2SO4。首先不用其他试剂就可鉴别出的是 ,如要继续鉴别余下两种,还需要选用的试剂是 ,现象分别为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
电解法是处理工业废水的一种重要方法。如酸性含(Cr2O72-)废水就可以采用电解法进行无害化处理。电解时采用Fe作阳极,惰性电极作阴极。已知:①氧化性:Cr2O72->Fe3+ ;②Cr2O72-被还原生成Cr3+;③Ksp[Cr (OH)3]=6.3×10-31。下列说法正确的是( )
A. 阳极材料也可以是Cu
B. 阴极每产生3molH2,则有1mol Cr2O72-被还原
C. 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
D. 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
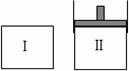
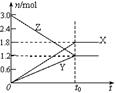
A.该反应的化学方程式为:3X+2Y 2Z
2Z
B.若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),
则容器Ⅱ达到平衡所需时间小于t0
C.若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
D.若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子一定能大量共存的是( )
A.25℃,由水电离出的c(H+)=10-11mol/L的溶液:Na+、K+、Cl-、ClO-
B.与Al反应能放出氢气的溶液:Na+、Ba2+、NO3-、Cl-
C.甲基橙变红的溶液:Na+、Mg2+、SO42-、Cl-
D.含Al3+的溶液:K+、Ca2+、Cl-、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.往石灰乳中通入过量的CO2:OH-+CO2=HCO3-
B.a mol FeBr2溶液中通入a mol Cl2:
2Fe2++2Br-+2Cl2 = Br2+2Fe3++4C1-
C.碳酸氢钙溶液加到醋酸中:
Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O
D.向50 mL 1 mol·L-1明矾溶液中滴入数滴0.1 mol·L-1Ba(OH)2溶液
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.π键是由两个p电子“头碰头”重叠形成
B.σ键是镜面对称,而π键是轴对称
C.乙烷分子中的键全为σ键而乙烯分子中含σ键和π键
D.H2分子中含σ键而Cl2分子中还含π键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列做法正确的是( )
|
| A. | 为了使火腿肠颜色更鲜红,可多加一些亚硝酸钠 |
|
| B. | 为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中多加着色剂 |
|
| C. | 食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿 |
|
| D. | 为保证人体所需足够蛋白质我们要多吃肉,少吃蔬菜和水果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com