

分析 (1)装置密闭,导气管关闭,改变烧瓶中的气体压强,打开分液漏斗活塞,加入水,看水是否顺利滴下来判断气密性;
(2)由装置图及药品可知,利用氯气与铁反应制取氯化铁.A中制取氯气,二氧化锰与浓盐酸反应生成氯化锰、氯气、水;
(3)制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,最后吸收尾气中未反应的氯气,防止污染空气;
(4)氯气中含水会导致生成的氯化铁发生水解,得不到纯净的氯化铁;
(5)B中硬质玻璃管内氯气与铁反应生成氯化铁.用KSCN溶液检验Fe3+,滴加KSCN溶液,溶液变成血红色,说明含有Fe3+;
(6)①根据滴定管的结构判断;
②Cl2能溶于水而难溶于饱和食盐水,故应用饱和食盐水,从而提高测量的准确性;
读数时应使圆底烧瓶内外气压相等,故读数前应使左右两边液面相平;
③滴定管内测量前后溶液体积变化为气体体积,俯视时,读取的液面的数值比实际偏小.
解答 解:(1)密闭导气管,依据分液漏斗中水的流下与否设计检查装置气密性,检查A装置的气密性的方法为:密闭导气管,打开分液漏斗的瓶塞,向漏斗中注入水,然后旋开旋塞,如水不能顺利滴下,气密性良好,
故答案为:密闭导气管,打开分液漏斗的瓶塞,向漏斗中注入水,然后旋开旋塞,如水不能顺利滴下,气密性良好.
(2)A中制取氯气,二氧化锰与浓盐酸反应生成氯化锰、氯气、水,反应方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,最后吸收尾气中未反应的氯气,防止污染空气,所以装置顺序为A→E→C→B→D,故答案为:E;C;B.
(4)如果进入B的气体不干燥,FeCl3容易水解,装置C的作用是干燥Cl2,防止FeCl3的水解.
故答案为:干燥Cl2防止FeCl3的水解;
(5)B中硬质玻璃管内氯气与铁反应生成氯化铁,B中因生成有FeCl3而出现棕(红)色的烟;用KSCN溶液检验Fe3+,滴加KSCN溶液,溶液变成血红色,说明含有Fe3+,
故答案为:棕(红)色的烟;KSCN溶液;
(6)①酸式滴定管下端由活塞,装置中的滴定管没有活塞,应是碱式滴定管,
故答案为:碱式滴定管;
②Cl2能溶于水而难溶于饱和食盐水,故应用饱和食盐水,从而提高测量的准确性.应使圆底烧瓶内外气压相等,读数前应上下移动滴定管,使左右两边液面相平,
故答案为:饱和食盐水;上下移动滴定管,使左右两边液面相平;
③俯视时,读取的液面的数值比实际偏小,滴定管内测量前后溶液体积变化偏大,导致所测气体的体积偏大,故答案为:偏大.
点评 本题有一定的综合性,把氯气的实验室制法和氯气的化学性质结合起来.考查学生对实验原理、实验装置的理解、物质的制备与性质,难度中等,(5)③为易错点,注意滴定管内测量前后溶液体积变化为气体体积,滴定管数值由上而下增大.


 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题
 某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).
某课外活动小组用如图所示装置制取氯水,并向盛有饱和氯水的烧杯中加入碳酸钙,以提高次氯酸的浓度(图中分液漏斗A中盛浓盐酸,B是二氧化锰).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点 | 沸点 | |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀~沉淀完全的pH | 2.7~4.1 | 3.7~5.2 | 7.5~9.6 | 8.6~10.1 | 9.6~11.1 |


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
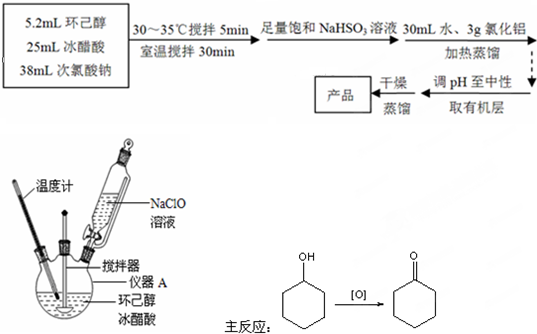
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| B. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| D. | 称取3.80g固体,加热至恒重,质量减少了0.620g.用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com