
已知可逆反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g) ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
A.增大压强 B.升高温度 C.增大CO的浓度 D.分离出CO2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某溶液中存在XO-,且X为短周期元素,则一定能在该溶液中大量共存的离子组是 ( )。
A.Na+、H+、SO42-、I- B.Na+、Ca2+、CO32-、Al3+
C.Na+、K+、Fe2+、H+ D.K+、SO42-、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的离子方程式不正确的是 ( )。
A.氨水使酚酞溶液变红:NH4++H2ONH3·H2O+H+
B.醋酸使碳酸钙溶解:CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2O
C.草酸溶液使酸性高锰酸钾溶液褪色:2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
D.向污水中投放明矾,生成能凝聚悬浮物的胶体:Al3++3H2OAl(OH)3(胶体)+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
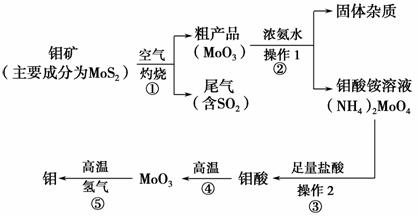
(1)写出反应①的化学方程式:________________________________________。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂________________________________________________________________。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_________________________________________________________________。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为________。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4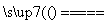 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O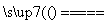 CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
醋酸是中学常用的一种弱酸。
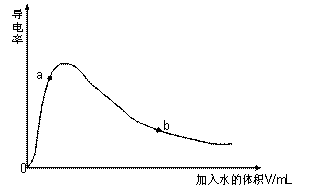
(1)取0.10mol CH3COOH作导电性实验,
测得其导电率随加入的水量变化如图所示:
开始时导电率为0说明: 。
② 比较a、 b点的相关性质(填“>”、“<”、“=”):
n(H+):a b;c(CH3COO-):a b;
完全中和时消耗NaOH的物质的量:a b;
③ 若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1=-57.3 kJ/mol
CH3COOH(aq) 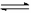 H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式:
。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子或分子组能大量共存,且满足相应要求的是
( )。
| 选项 | 离子或分子 | 要求 |
| A | K+、NO3-、Cl-、HCO3- | c(K+)<c(Cl-) |
| B | Ca2+、NO3-、SO32-、Cl- | 滴加盐酸立即有气体产生 |
| C | NH4+、Al3+、SO42-、Br- | 逐滴滴加NaOH溶液立即有气体产生 |
| D | Na+、HCO3-、Mg2+、SO42- | 滴加氢氧化钠溶液立即有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最 后通入足量的SO2气体。
后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为_________________________ ________________________________ ___________________________;
___________________________;
(2)实验③中的现象为______________________________________________。
(3)实验①、②中反应的离子方程式分别是_____________________________、_________________________________ ______________________________。
______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
近年来地质、环境灾难频频发生,为防止在大灾之后疫病流行,灾区需要大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3与SO2在H2SO4作用下反应制得。请写出反应的离子方程式:_________________________________________________________________。
(2)过碳酸钠是一种新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是________。
A.MnO2 B.KMnO4溶液
C.稀盐酸 D.Na2SO3溶液
(3)漂白剂亚氯酸钠(NaClO2)在常温下黑暗处可保存一年,HClO2不稳定可分解,反应的离子方程式为HClO2―→ClO2↑+H++Cl-+H2O(未配平)。当1 mol HClO2分解时,转移的电子数是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com