
����Ŀ�������������
��I��������һ�������¿�������������
A��̼�����ӣ�CH3+ �� B��̼�����ӣ�CH3���� C���� ����CH3�� D��̼ϩ����CH2��
���������У�����Ϊ120�����������ţ���
��̼�����ӣ�CH3�����Ŀռ乹��Ϊ �� ��CH3����Ϊ�ȵ������һ�ַ��������ѧʽ����
��II ������ȡ�ϳɰ�ԭ�����Ĺ����У�������һЩ���ʣ���CO��ʹ�����ж�����ȥCO�Ļ�ѧ����ʽΪ��HAc��ʾ���ᣩ��Cu��NH3��2Ac+CO+NH3=Cu��NH3��3��CO��Ac����ش��������⣺
��C��N��O�ĵ縺���ɴ�С��˳��Ϊ ��
��д��Cu�ĺ�������Ų�ʽ ��
�ۻ�����Cu��NH3��3��CO��Ac�У�����Ԫ�صĻ��ϼ�Ϊ ��
����һ��������NH3��CO2�ܺϳ�����CO��NH2��2 �� ������Cԭ�ӹ�����ӻ�����Ϊ��1mol���ط����У��� ������ĿΪ ��
��Cu2O����ľ����ṹ��ͼ��ʾ��������٤������ΪNA �� �����ı߳�Ϊapm��������ܶ�Ϊgcm��3 �� 
���𰸡�A�������Σ�NH3��O��N��C��1s22s22p63s23p63d104s1��[Ar]3d104s1��+1��sp2��7NA��![]()
���������⣺��I�� ��A��̼�����ӣ�CH3+������3���Ҽ���û�йµ��Ӷԣ�̼ԭ���ӻ���ʽ��sp2 �� Ϊƽ�������νṹ������Ϊ120�㣬��A��ȷ��
B��̼�����ӣ�CH3��������3���Ҽ���1�Թµ��Ӷԣ�̼ԭ���ӻ���ʽ��sp3 �� Ϊ�����νṹ������Ϊ����120�㣬��B����
C��������CH3������3���Ҽ���1���µ��ӣ�̼ԭ���ӻ���ʽ��sp3 �� Ϊ�����νṹ������Ϊ����120�㣬��C����
D��̼ϩ����CH2������2���Ҽ���1�Թµ��Ӷԣ�̼ԭ���ӻ���ʽ��sp2 �� Ϊƽ�������νṹ�����ڹµ��ӶԳ�������Ϊ����120�㣬��D����
���Դ��ǣ�A����̼�����ӣ�CH3��������3���Ҽ���1�Թµ��Ӷԣ�̼ԭ���ӻ���ʽ��sp3 �� Ϊ�����νṹ��CH3��ԭ�Ӹ���Ϊ4���۵�����Ϊ8������CH3����Ϊ�ȵ������һ�ַ�����NH3 �� ���Դ��ǣ������Σ�NH3����II ����ͬ���ڴ����ҵ縺��Խ��Խ������C��N��O�ĵ縺���ɴ�С��˳��ΪO��N��C�����Դ��ǣ�O��N��C����ͭԭ����29�ţ����ݹ���ԭ��д����������Ų�Ϊ1s22s22p63s23p63d104 s1��[Ar]3d104 s1 �� ���Դ��ǣ�1s22s22p63s23p63d104 s1��[Ar]3d104 s1����Ac����ʾ�����������������嶼�Ƿ��ӣ������磬����ͭ�Ļ��ϼ�Ϊ+1�ۣ����Դ��ǣ�+1��������ԭ��Ϊ̼�������1����ԭ�ӣ�2����ԭ�ӣ���C�¶Ե��ӣ����Լ۲���Ӷ�Ϊ3�ԣ����ӻ����Ϊsp2��ÿ��̼�ĦҼ�Ϊ3����ÿ���ǰ����ЦҼ�����Ŀ2��һ���������к��Ҽ�����ĿΪ3+2��2=7����ÿĦ�������к��ЦҼ�����ĿΪ7NA �� ���Դ��ǣ�sp2��7NA��
��Oԭ���ھ����Ķ�������ģ���Oԭ����=8�� ![]() +1=2��Cuԭ��ȫ�������ģ���Cuԭ����=4����һ��������ͭ��������2��Oԭ�Ӻ�4��Cuԭ�ӣ���2��Cu2O�������������ܶȦ�=
+1=2��Cuԭ��ȫ�������ģ���Cuԭ����=4����һ��������ͭ��������2��Oԭ�Ӻ�4��Cuԭ�ӣ���2��Cu2O�������������ܶȦ�= ![]() =
= ![]() =
= ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������̼����ȼ�ϵ����Li2CO3��K2CO3Ϊ����ʡ���CH4Ϊȼ��ʱ���õ�ع���ԭ������ͼ��˵����ȷ����
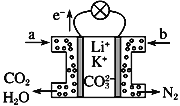
A. aΪCH4��bΪCO2 B. CO![]() �������ƶ�
�������ƶ�
C. �˵���ڳ���ʱҲ�ܹ��� D. �����缫��ӦʽΪO2��2CO2��4e��===2CO![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���ã�
��1����ͼ��N2��g����H2��g����Ӧ����1mol NH3��g�������������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ���� 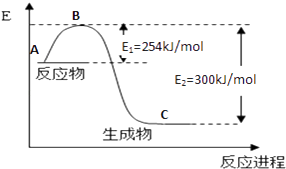
��2������֪�������ݣ�
��ѧ�� | H��H | N��N |
����/kJmol��1 | 435 | 943 |
�Ը��ݱ��м�ͼ�����ݼ���N��H�ļ���kJmol��1
��3���ϳɰ���Ӧͨ��������ý��������ʹ������ý��E1��E2�ı仯�ǣ�E1 �� E2�����������С���������䡱����
��4����NH3����ԭNOX���������������������Ⱦ������ 4NH3��g��+3O2��g��=2N2��g��+6H2O��g������H1=akJ/mol
N2��g��+O2��g��=2NO��g������H2=bkJ/mol
��1mol NH3��ԭNO��N2 �� ��÷�Ӧ�����еķ�Ӧ�ȡ�H3=kJ/mol���ú�a��b��ʽ�ӱ�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��ش��������⣺
��1������������������ˮ�����侻ˮ��ԭ����________________________�������ӷ���ʽ��ʾ����
��2����֪MgO������NH4Cl��ˮ��Һ���û�ѧ����ʽ��ʾ��ԭ��________________________��
��3��ȥ��8��12����������������Σ��Ʒ�ֿⷢ����ը�¹ʣ������軯����ը�������й©��CNһ�о綾��й¶����ȾˮԴ�Ϳ�������Ҫ������
����֪HCNΪһԪ���ᣬ��NaCN��Һ��pH _____________7������>����=������<�����������ӷ���ʽ˵��_____________________________��
�ڴ�����CNһ��ˮ�ķ���֮һ��������������£�CN��������������HCO3һ��ͬʱ����NH3���÷�Ӧ�����ӷ���ʽΪ___________________________________________________��
��4�������£�ȡ0.2 mol��L��1 HCl��Һ��0.2 mol��L��1 MOH��Һ�������ϣ������Һ��Ϻ��pH��5��д��MOH�ĵ��뷽��ʽ��____________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1��4�����ϩ��X���л��ϳɵĻ���ԭ�ϣ������з������Ժϳ�F��ͼ1�� 

��1����֪C�����Ƶ�������ͭ�������ɺ�ɫ������X�Ƿ���������ԭ�ӹ�ƽ���������X�Ľṹ��ʽΪ �� X��һ�����������ɵĸ߷��ӻ�����Ľṹ��ʽΪ ��
��2���ٵķ�Ӧ������ �� F�����������ŵ������� ��
��3��1��4�����ϩ�����̼ԭ����Ϊ �� ����һ��ͬ���칹��Ϊ ![]() �����л����ϵͳ����Ϊ ��
�����л����ϵͳ����Ϊ ��
��4����B��Ϊͬ���칹���T���л��ϳɵ��м��壬���ĺ˴Ź���������ͼ2��ʾ����T�Ľṹ��ʽΪ ��
��5����Ӧ�ڵĻ�ѧ����ʽΪ �� ��Ӧ���������г�ˮ�������Ļ�ѧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص������Һ��˵����ȷ������ ��
A. ��0.1 molL-1CH3COOH��Һ�м�������ˮ����Һ�� ��С
��С
B. ��CH3COONa��Һ��20��������30������Һ��  ����
����
C. �������м��백ˮ�����ԣ���Һ�� >1
>1
D. ��AgCl��AgBr�ı�����Һ�м�������AgNO3��Һ�� ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ӧ�����ӷ���ʽ��д��ȷ���ǣ� ��
A.������þ��ϡ���ᷴӦ��H++OH���TH2O
B.�Ȼ�����Һ����������Һ��Ӧ��Ba2++SO ![]() �TBaSO4��
�TBaSO4��
C.FeCl3��Һ�м���Fe�ۣ�Fe3++Fe�T2Fe2+
D.̼������Һ���������ᷴӦ��Na2CO3+2H+�T2Na++CO2��+H20
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ɫ������A�ڳ��º���������£������ȶ����ڣ�������ˮ��Һ�в��ȶ���һ��ʱ���ת��Ϊ���ɫ������ͬʱ����һ�����嵥�ʣ�Ϊ̽����ɷ֣�ij��ѧ��ȤС���ͬѧȡ������A��ĩ����ʵ�飮����ɷ������÷�ĩ������O��K��Fe����Ԫ�أ���ȡ3.96g������A�ķ�ĩ����ˮ���μ�������ϡ���ᣬ��Ӧ�����Һ�м��뺬��0.08mol��KOH����Һ��ǡ����ȫ��Ӧ�����ˣ���ϴ�Ӻ�ij���������գ��õ�����ɫ�����ĩ1.60g����������Һ��һ�������������ɵõ�һ�ִ����IJ����ᾧˮ����10.44g��
��1��������A�Ļ�ѧʽΪ������A��H2O��Ӧ�����ӷ���ʽΪ�� ��
��2��������A����Ϊһ�֡���ɫ��Ч��ܡ�ˮ������������FeCl3��KClO��ǿ���������·�Ӧ�Ƶã��䷴Ӧ�����ӷ���ʽΪ
��3��������A��������Ϊ��������ز��ϣ���MnO2��Zn������ƣ�A��ZnҲ������ɼ��Ե�أ�A�ڵ������Ϊ�������ϣ���缫��ӦʽΪ �� �õ���ܷ�Ӧ�����ӷ���ʽΪ ��
��4��Ŀǰ��������Ի�����A���ȶ��Խ����˴�����̽������ȡ����һ���Ľ�չ�������������п����������Aˮ��Һ�ȶ��Ե���
A.������
B.����
C.Fe��NO3��3
D.KOH
��5�������һ��ʵ�鷽�����о��¶ȶԻ�����Aˮ��Һ�ȶ��Ե�Ӱ�죺 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼΪ����ȼ�ϵ��ԭ��ʾ��ͼ�����մ�ͼ����ʾ���ش��������⣺ 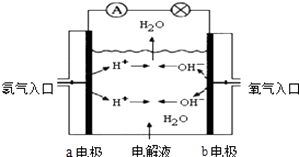
��1��������������ȷ���� A a�缫�Ǹ���
B b�缫�ĵ缫��ӦΪ��4OH����4e��=2H2O+O2��
C ����ȼ�ϵ����һ�־���Ӧ��ǰ������ɫ��Դ
D ����ȼ�ϵ����һ�ֲ���Ҫ����ԭ����������ȫ�������ڵ���ڵ����ͷ���װ��
��2�����������ҺΪKOH��Һ����缫��ӦʽΪ��a��b��
��3�����������ҺΪϡH2SO4 �� ��缫��ӦʽΪ��a��b��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com