

| 4 |
| 5 |
| 0.4mol |
| 1mol |
| 5 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
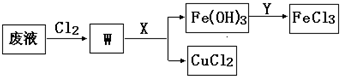 我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用.
我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| B、pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) |
| C、pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| D、pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n |
| 2 |
| 3n |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 可用示意图表示的是( )
可用示意图表示的是( )| 反应 | 纵坐标 | 甲 | 乙 | |
| A |
2molSO2与1 molO2,在相同温度下2SO2+O2?SO3 | SO3的物 质的量 |
10个大 气压 |
2个大气 压 |
| B |
相同质量氨气,在同一容器中2NH3?N2+3H2;△H>0 | 氨气的 转化率 |
400℃ | 500℃ |
| C |
体积比1:3的N2、H2,在体积可变的恒压容器中N2+3H2?2NH3; | 氨气的浓度 | 活性高的 催化剂 |
活性一般 的催化剂 |
| D | 等质量钾、钠分别与水反应 | H2质量 | 钠 | 钾 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/°C | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在澄清石灰水中加入少量小苏打:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| B、苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| C、将少量SO2气体通入NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、将标准状况下112mL氯气通入10mL浓度为1mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2═3Fe3++6Cl-+2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 常温下,用0.1mol/L CH3COOH溶液滴定20mL O.1mol/L NaOH溶液的滴定曲线如图所示,则在混合后的溶液中下列粒子浓度的关系式干不正确的是(忽略溶液混合时体积变化)( )
常温下,用0.1mol/L CH3COOH溶液滴定20mL O.1mol/L NaOH溶液的滴定曲线如图所示,则在混合后的溶液中下列粒子浓度的关系式干不正确的是(忽略溶液混合时体积变化)( )| A、pH=8时:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、a点时:c(OH-)=c(H+)+c(CH3COO-)+c(CH3COOH) |
| C、PH=7时:c(CH3COO-)+c(H+)=c(Na+)+c(OH-) |
| D、b点时:c(CH3COO-)+c(CH3COOH)=0.05mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 硼镁矿 | 硼砂 | 硼酸 | 偏硼酸钠 |
| Mg2B2O5?H2O | Na2B4O7?10H2O | H3BO3 | NaBO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com