
决定化学反应速率的主要因素是
| A.反应物的性质 | B.反应温度 |
| C.反应物的浓度 | D.使用催化剂 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:单选题
二氧化硫的催化氧化原理为2SO2(g)+O2(g) 2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是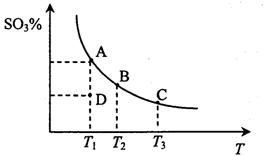
A.在D点时v E<v逆
B.反应2SO2(g)+O2(g) 2SO3(g)的△H<0
2SO3(g)的△H<0
C.若B、C点的平衡常数分别为KB、KC,则KB>KC
D.恒温恒压下向平衡体系中通入氦气,平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
把镁条投入到盛有盐酸的敞口容器里,产生H2的速率可由图表示。在下列因素中:①盐酸的浓度;②镁条的表面积;③溶液的温度;④Cl 的浓度。影响反应速率的因素是
的浓度。影响反应速率的因素是 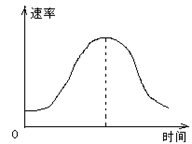
| A.①④ | B.③④ |
| C.①②③ | D.②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志。目前主要生产方法是“接触法”,有关2SO2+O2 2SO3的说法中,不正确的是
2SO3的说法中,不正确的是
| A.该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 |
| B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻之后,正、逆反应速率相等 |
| D.平衡时SO2、O2、SO3的分子数之比不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是
| A.原电池负极被氧化 |
| B.任何化学反应都能设计成原电池 |
| C.化学反应的速率和限度均可通过改变化学反应条件而改变 |
| D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
密闭容器中,反应xA(g)+yB(g)  zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是 ( )
zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L下列判断错误的是 ( )
| A.x+y>z | B.平衡向正方向移动 |
| C.B的转化率降低 | D.C的体积分数下降 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
过量的铁粉与100 mL 0.1 mol/L的稀盐酸反应,反应速率太快。为了降低此反应速率而不改变产生H2的量,可以使用如下方法中的( )
①加H2O ②加NaOH固体 ③滴入过量浓硫酸 ④加少量的CH3COONa固体 ⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 1 mol/L的盐酸
| A.①⑥⑦ | B.①④⑤ | C.③⑦⑧ | D.③⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,将两种气体M和N通入容积为V L的密闭容器中进行反应,M和N的物质的量与时间的关系如图所示,下列说法不正确的是 ( )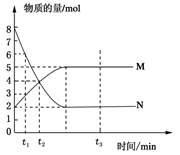
| A.t2时M与N的物质的量浓度之比为1:1 |
| B.t2与t3时刻的混合气体的平均相对分子质量相等 |
| C.反应物与生成物平衡时的物质的量浓度之比是2:5 |
D.0~t2内用M表示的平均反应速率是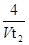 mol/(L?min) mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(2分)某温度时,在2L固定体积的密闭容器中X、Y、Z三种气体随时间的变化如图所示: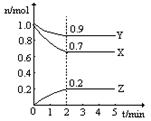
(1)该反应的化学方程式为 ;
(2)下列表示该反应速率最大的是
A.v(X)=0.6mol/(L·s) B.v(Y)=0.3mol/(L·s) C.v(Z)=0.5mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com