
分析 纯水存在电离平衡,电离出的氢离子浓度和氢氧根离子浓度相同;在酸溶液、碱溶液、盐溶液中存在离子积常数,Kw随温度变化;加热促进水的电离,酸碱抑制水的电离,水解的盐抑制水的电离.
解答 解:25℃时,水中c (H+)=c(OH-)=1×10-7mol/L,此时水的离子积Kw=c (H+)×c(OH-)=1×10-14,水的PH=-lgc(H+)=7,加热至99℃,水中c (H+)=1×10-6mol/L,说明升高温度会促进水的电离,加入硫酸会抑制水的电离,加入KCl对水的电离不影响,
故答案为:1×10-14;7;促进;抑制;不影响.
点评 本题考查了影响水的电离平衡的因素,离子积常数的计算,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3 NA | |
| C. | 0.2 mol Cl2与足量的铁粉充分反应,转移电子数为0.6NA | |
| D. | 标准状况下,11.2 L 氯仿所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl=K++Cl- | B. | H2CO3?2 H++CO32- | ||
| C. | H2SO4=2H++SO42- | D. | Ba(OH)2=Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水跟盐酸反应:OH-+H+→H2O | |
| B. | 铁与硝酸银溶液反应:Fe+Ag+→Fe2++Ag | |
| C. | 氢氧化铜与稀硫酸反应:Cu(OH)2+2H+→Cu2++2H2O | |
| D. | 氢氧化钡跟稀硫酸反应:Ba2++OH-+H++SO42-→BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属钠与足量水反应中,增加水的量能加快反应速率 | |
| B. | 工业生产使用催化剂是为了加快反应速率,提高生产效率 | |
| C. | 2SO2+O2?2SO3反应中,SO2的转化率不能达到100% | |
| D. | 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入3mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入3mL 5% H2O2溶液和3mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
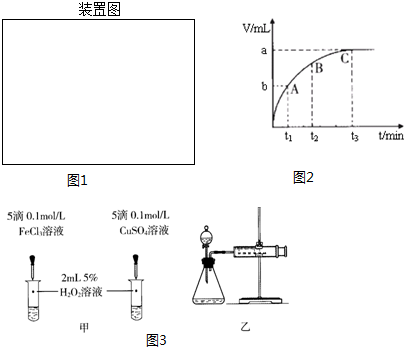
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
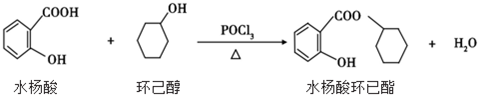
| A. | 水杨酸的核磁共振氢谱有 4 个吸收峰 | |
| B. | 水杨酸、环已醇和水杨酸环已酯都能与 FeCl3 溶液发生显色反应 | |
| C. | 1mol 水杨酸跟浓溴水反应时,最多消耗 2molBr2 | |
| D. | 1mol 水杨酸环已酯在 NaOH 溶液中水解时,最多消耗 3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4和Ba(OH)2 | B. | CO2和NaOH | C. | CaCO3和HCl | D. | Mg(OH)2和CuSO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com