

| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取半透膜外液体,加入少量碘水 | 液体没有变成蓝色,证明淀粉不能透过半透膜 |
| ② | 另取半透膜外液体,加入足量稀盐酸和少量1mol/L BaCl2溶液 | 产生不溶于盐酸的白色沉淀,证明SO42-能够透过半透膜 |


科目:高中化学 来源: 题型:
| A、1molCl2发生反应时,转移的电子数一定为2NA |
| B、1.7g H2O2中含有的电子数为0.9 NA |
| C、1mol Na2O2 固体中含离子总数为4 NA |
| D、标准状况下,2.24L苯所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 4 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
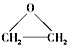 ),该反应的原子利用率为100%,反应的化学方程式为
),该反应的原子利用率为100%,反应的化学方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示为鲁科版化学教科书(我们正在使用的教科书)必修1中“迁移应用”栏目的一个学习活动.下列关于a、b、c、d处所填内容及这幅图含义的描述中,不正确的是( )
如图所示为鲁科版化学教科书(我们正在使用的教科书)必修1中“迁移应用”栏目的一个学习活动.下列关于a、b、c、d处所填内容及这幅图含义的描述中,不正确的是( )| A、a=1.204×1024、b=6.02×1023、c=2、d=1 |
| B、6.02×1023个H2O水分子中含有1.204×1024个氢原子和6.02×1023个氧原子 |
| C、1mol H2O中含有2mol H和1mol O |
| D、对于同一微粒,其物质的量与微粒数间可通过阿伏加德罗常数实现相互换算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向1 mol?L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |
| B、可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体 |
| C、氢氧化铁胶体通电后氢氧化铁胶粒向正极移动 |
| D、由0.1mol氯化铁制取的氢氧化铁胶体中,氢氧化铁胶粒数目为0.1NA(设NA表示阿伏加德罗常数的值) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com