
| A�� | ��Һ�е���������H+��Mg2+��Al3+��NH4+ | |
| B�� | ��Һ��n��NH4+��=0.2 mol | |
| C�� | ��Һ��һ������CO32-��NO3-�����ܺ���SO42- | |
| D�� | n��H+����n��Al3+����n��Mg2+��=2��2��1 |
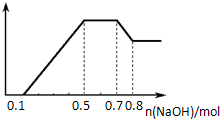
���� ������п����������ɫ��ζ�������壬˵�������������������Һ�����ԣ���CO32-��NO3-���ܴ������棻����NaOH��Һ��������ɫ������˵�������������ӣ����ݲ����ij����������NaOH�����ʵ���֮��Ĺ�ϵͼ��֪����Һ��һ������Mg2+��Al3+������Ϊ�������ﵽ���ֵʱ�����������������ƣ��������䣬��˵����Һ�л�����NH4+��������Һ�л�������������ӣ�����һ������SO42-�����ͼ���и������ĵ��������ƣ�������Һ��n��H+����n��Mg2+����n��Al3+����n��NH4+�����ݴ˽��
��� �⣺������п����������ɫ��ζ�������壬˵�������������������Һ�����ԣ���CO32-��NO3-���ܴ������棻
����NaOH��Һ��������ɫ������˵��������Fe3+�����ݲ����ij����������NaOH�����ʵ���֮��Ĺ�ϵͼ��֪����Һ��һ������Mg2+��Al3+������Ϊ�������ﵽ���ֵʱ�����������������ƣ��������䣬��˵����Һ�л�����NH4+��������Һ�л�������������ӣ�����һ������SO42-��
��ͼ���֪����һ��Ϊ���������������Ʒ�Ӧ��������������Ϊ0.1mol����n��H+��=0.1mol��
������Ϊ笠��������������Ʒ�Ӧ��������������Ϊ0.7mol-0.5mol=0.2mol����n��NH4+��=0.2mol��
����Ϊ���������ܽ�����������������������0.8mol-0.7mol=0.1mol����n[Al��OH��3]=0.1mol��������Ԫ���غ��֪n��Al3+��=0.1mol��
�ڶ���Ϊ�������Ƴ���þ���ӡ������ӣ���������������Ϊ0.5mol-0.1mol=0.4mol����n��Mg2+��=��0.4mol-0.1mol��3����2=0.05mol��
A��������������֪����Һ�е�������ֻ��H+��Mg2+��Al3+��NH4+����A��ȷ��
B��������������֪����Һ��n��NH4+��=0.2mol����B��ȷ��
C��������������֪����Һ��һ������CO32-��NO3-��һ������SO42-����C����
D��������������֪����Һ��n��H+����n��Al3+����n��Mg2+��=0.1mol��0.1mol��0.05mol=2��2��1����D��ȷ��
��ѡC��
���� ���⿼�����ӹ��桢��Ӧͼ��ʶ���Լ����ӷ�Ӧ�йؼ���ȣ��Ǹ߿��еij������ͣ���ѧ�����ۺ���������˸��ߵ�Ҫ������������ѧ������˼ά�����ͷ�ɢ˼ά�������ѶȽϴ�


 Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol/L�ģ�NH4��2SO4��Һ�У�c ��SO42-����c ��NH4+ ����c ��H+����c ��OH-�� | |
| B�� | 0.2 mol/L��Na2CO3��Һ�У�c ��OH-��=c ��HCO3-��+c ��H+��+c ��H2CO3�� | |
| C�� | 0.1 mol/L��NH4Cl��Һ��0.05 mol•L-1��NaOH��Һ�������ϣ�������Һ�У�c ��Cl-����c ��NH4+ ����c ��Na+ ����c ��H+����c ��OH-�� | |
| D�� | c ��NH4+����ȵģ�NH4��2SO4��Һ����NH4��2CO3��Һ��NH4C1��Һ�У�c[��NH4��2SO4]��c[��NH4��2CO3]��c ��NH4C1�� �ڢ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 283kJ | B�� | 374.4kJ | C�� | 512kJ | D�� | 566kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��H=-484kJ/mol | B�� | ��H=+484kJ/mol | C�� | ����484kJ ���� | D�� | �ų�484kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.5molO3��11.2LO2�����ķ�����һ����� | |
| B�� | ���ܱ������м���1.5 mol H2��0.5 molN2����ַ�Ӧ��ɵõ�NH3������ΪNA | |
| C�� | ���³�ѹ�£�7.0g��ϩ�붡ϩ�Ļ�����к�����ԭ�ӵ���ĿΪNA | |
| D�� | ��״���£�22.4 L�������������۳�ַ�Ӧ��ת�Ƶĵ�����Ϊ3 NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 98g H2SO4��Ħ����Ϊ1 | |
| B�� | �����ӵ�����Ϊ6.02��1023 | |
| C�� | ����Ħ������Ϊ32 | |
| D�� | ij������Һ��H2SO4����������Ϊ0.60 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | pH��Ϊ3����Һ����ˮϡ��10�����pH��HCl��H2SO4��CH3COOH | |
| B�� | Ũ�Ⱦ�Ϊ0.1mol•L-1�İ�ˮ���Ȼ����Һ��ˮ�������c��H+��ǰ��С�ں��� | |
| C�� | ̼������Һ�д��ڣ�c��OH-��=c��H+��+c��H2CO3��+c��CO32-�� | |
| D�� | 0.1mol/L Na2CO3��Һ35��ʱ�ļ��Ա�25��ʱǿ��˵������ˮ�ⷴӦ�Ƿ��ȷ�Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com