
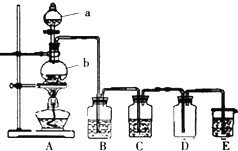
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气;所含元素化合价升高的反应物是还原剂;
(2)氯气中混有HCl,用饱和食盐水除去氯气中的HCl;氯气有毒,不能直接排放空气中,E装置中盛放氢氧化钠溶液吸收氯气;
(3)由方程式可知,146gHCl与87gMnO2恰好完全反应,浓盐酸与二氧化锰发生氧化还原反应,但稀盐酸不与二氧化锰反应;
(4)氯气具有强氧化性,可以将I-离子氧化为I2,碘遇淀粉变蓝色;
由题目信息可知,Cl2将溶液中的I2氧化成HIO3,自身被还原为HCl,配平书写方程式.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气,反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,反应中HCl中Cl元素化合价升高,故HCl是还原剂;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;HCl;
(2)氯气中混有HCl,用饱和食盐水除去氯气中的HCl;氯气有毒,不能直接排放空气中,E装置中盛放氢氧化钠溶液吸收多余氯气,防止污染空气,
故答案为:除去氯气中的HCl;吸收多余氯气,防止污染空气;
(3)由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,可知146gHCl与87gMnO2恰好完全反应,①中随反应进行,浓盐酸变稀,稀盐酸不与二氧化锰反应,HCl不能完全反应,生成氯气小于1mol,②中浓盐酸足量,87gMnO2完全反应,生成氯气为1mol,制备的氯气②比①多,
故答案为:B;
(4)氯气具有强氧化性,可以将I-离子氧化为I2,反应离子方程式为:2I-+Cl2=2Cl-+I2,溶液变成蓝色,
由题目信息可知,Cl2将溶液中的I2氧化成HIO3,自身被还原为HCl,反应方程式为:5Cl2+I2+6H2O=2HIO3+10HCl,
故答案为:蓝;2I-+Cl2=2Cl-+I2;5Cl2+I2+6H2O=2HIO3+10HCl.
点评 本题考查氯气的实验室制备、氯气的性质,注意浓盐酸和二氧化锰能反应生成氯气,稀盐酸和二氧化锰不反应,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 分子式为C5H12的烃有三种可能的结构 | |
| B. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| C. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| D. | 淀粉、纤维素和蛋白质都是高分子化合物,它们在一定条件下都能水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
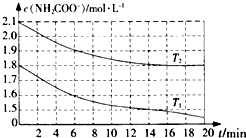 科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.
科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是利用氧化还原反应将化学能转化成电能的装置 | |
| B. | 金属A与B用导线连接后插入稀硫酸中组成原电池时,A是正极,则B的金属性强于A | |
| C. | 化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 | |
| D. | 对于反应N2(g)+3H2(g)?2NH3(g),单位时间里每增加1molN2,同时增加3molH2,说明反应到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
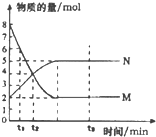
| A. | 反应式中a:b=2:5 | |
| B. | 0-t1物质M的浓度c(M)减少了1mol•L-1 | |
| C. | t2时,c(M)=c(N)=4mol•L-1,反应一定达到平衡状态 | |
| D. | t3时,c(M)不再变化,正反应速率小于逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
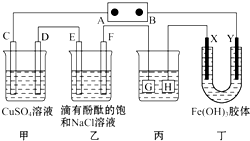 如图所示装置,C,D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极,将直流电源接通后,F极附近溶液呈红色.请回答:
如图所示装置,C,D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极,将直流电源接通后,F极附近溶液呈红色.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com