
| A. | 通过测定大米浸泡液的pH检验大米新鲜度 | |
| B. | 用含Fe2+的检测试剂检验自来水中余氯的含量 | |
| C. | 向食盐样品中加还原剂和淀粉检测食盐的含碘量 | |
| D. | 通过观察放入检测液中鸡蛋的沉浮检验鸡蛋新鲜度 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=9.1×10-8 K2=1.1×10-12 |
| A. | 等物质的量浓度的各溶液 pH 关系为:pH(Na2S)>pH(NaCN)>pH(NaHS)>pH(CH3COONa) | |
| B. | 用 0.1mol/L 的 NaOH 溶液滴定 pH 值相等的CH3COOH和 HCN 溶液,CH3COOH消耗的NaOH溶液体积 更大 | |
| C. | NaHS 和Na2S 的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)+c(H2S) | |
| D. | 某浓度的NaCN溶液的 pH=d,则其中由水电离出的c(OH-)=10-4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
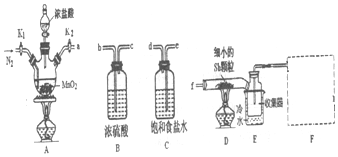
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6O2属于酯时有三种同分异构体 | |
| B. | 乙醇、乙酸均能与钠反应放出H2,二者分子中官能团相同 | |
| C. | 向 溶液中通入CO2可得到 溶液中通入CO2可得到 | |
| D. | CH3COOH与CH3CH218OH发生酯化反应可生成CH3CO18OCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4和SiC都属于有机物 | |
| B. | 甲醇和乙酸均能与金属钠反应 | |
| C. | C3H6Cl2的同分异构体有3种 | |
| D. | 若分子式为C5H10O2的酯的水解产物之一为乙醇,则该酯的结构有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
已知:SO +Br2+H2O―→SO
+Br2+H2O―→SO +2Br-+2H+。某溶液中可能含有Na+、NH
+2Br-+2H+。某溶液中可能含有Na+、NH 、Fe2+、K+、Br-、SO
、Fe2+、K+、Br-、SO 、SO
、SO ,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
,且所有离子物质的量浓度相等。向该无色溶液中滴加少量氯水,溶液仍呈无色。下列关于该溶液的判断正确的是( )
A.肯定不含Br- B.无法确定SO 是否存在
是否存在 
C.肯定含有SO D. 肯定含有Na+
D. 肯定含有Na+
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:推断题
某无色溶液中可能存在如下几种阴阳离子:
阳离子 | Al3+、Fe2+、Ba2+、Na+、NH4+ |
阴离子 | Cl—、CO32—、SO4 |
现对该溶液样品进行以下研究:
Ⅰ.向溶液中加入稀盐酸后有无色气体生成,该气体遇空气变成红棕色;
Ⅱ.若向Ⅰ所得溶液中加入BaCl2溶液,有白色沉淀生成;
Ⅲ.若向Ⅰ所得溶液中加入过量NaOH浓溶液并加热,产生有刺激性气味的气体,最终溶液无沉淀生成;
Ⅳ.向Ⅲ所得溶液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该溶液中一定存在的阳离子为 ,一定不存在的离子为 。
(2)检验溶液中可能还存在的阳离子的方法为 。
(3)写出实验Ⅰ发生反应的离子方程式: 。
(4)写出实验Ⅳ中生成白色絮状沉淀的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com