
| A、一定有乙烷 |
| B、一定有甲烷 |
| C、一定没有甲烷 |
| D、不一定有甲烷 |
| 1.5mol |
| 1mol |
| 2mol×2 |
| 1mol |


科目:高中化学 来源: 题型:
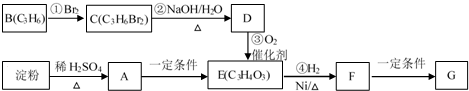
| H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 成分 | Na+ | K+ | Ca 2+ | Mg 2+ | Cl- | SO4 2- | HCO3- |
| 含量/mg?L-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、H2R是二元弱酸,其Ka1=1×10-2 |
| B、当溶液恰好呈中性时,c( Na +)=2c ( R2-)+c( HR-) |
| C、NaHR在溶液中水解倾向大于电离倾向 |
| D、含Na2R与NaHR各0.1 mol的混合溶液的pH=7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| R | ||
| X | M | Y |
| T |
查看答案和解析>>
科目:高中化学 来源: 题型:
 石灰石(主要成分为CaCO3)是重要的工业原料,
石灰石(主要成分为CaCO3)是重要的工业原料,| 物理量/单位 实验序号 | m(CaCO3)/g | V(2mon?L-1HCl)/mL | V(H2O)/mL | |
| 1 | P | 20 | 0 | |
| 2 | P |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.0 mol?L-1 KNO3溶液:H+、Fe2+、Cl-、SO42- |
| B、能溶解Al2O3的溶液:Na+、K+、Cl-、SiO32- |
| C、无色透明溶液中:Al3+、Cu2+、Cl-、HCO3- |
| D、使甲基橙变红色的溶液:Mg2+、K+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=6的纯水:c(OH-)<c(H+) |
| B、0.1mol?L-1的(NH4)2SO4溶液:c(NH4+)>c(SO42-)>c(H+) |
| C、常温下,pH=7的醋酸与醋酸钠的混合溶液:c(CH3COO-)>c(Na+) |
| D、常温下,pH=2的一元酸和pH=12的一元强碱等体积混合后所得溶液:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、阿魏酸的分子式为C10H10O4 |
| B、香兰素、阿魏酸均可与NaOH、NaHCO3溶液反应 |
| C、可用酸性KMnO4溶液检测上述反应是否有阿魏酸生成 |
| D、一定条件下,香兰素、阿魏酸都能发生取代、加成、消去反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com