
| A. | 一定小于92.0 kJ | B. | 一定等于92.0 kJ | C. | 一定大于92.0 kJ | D. | 不能确定 |
科目:高中化学 来源: 题型:解答题
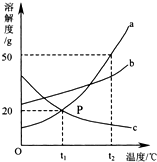 如图是A、B、C三种固体物质的溶解度曲线图,请回答:
如图是A、B、C三种固体物质的溶解度曲线图,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌电极上发生还原反应 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)不变 | |
| C. | 电池工作一段时间后,甲池溶液的总质量增加 | |
| D. | 该装置将化学能转化为电能,一段时间后,装置内的电子总量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60 g SiO2晶体中含有Si-O键数目为2NA | |
| B. | 常温常压下,1.6 9 O2和O3的混合气体所含电子数为0.8NA | |
| C. | 1 mol/L AICl3溶液中,所含Al3+数目小于NA | |
| D. | 密闭容器中2 mol NO与l mol 02充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-?I3-,上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).
实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-?I3-,上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com