
| A. | 耐高温的材料 | B. | 半导体 | C. | 催化剂 | D. | 农药 |
分析 本题根据元素周期表中的元素分布及元素常见的性质来解题,一般金属延展性较好,可用于做合金,金属元素和非金属元素交界处的元素可以制作半导体材料,一般过度金属可以用来做催化剂,农药分为有机和无机,一般非金属元素可以制作有机农药.
解答 解:A.在过渡元素找中耐高温的材料,故A错误;
B.在金属元素和非金属元素交接区域的元素可以用来做良好的半导体材料,像硅等,故B正确;
C.可以用于做催化剂的元素种类较多,一般为过渡金属元素,故C错误;
D.非金属元素位于右上方,非金属可以制备有机溶剂,部分有机溶剂可以用来做农药,故D错误.
故选B.
点评 本题考察了元素周期表中,如硅等,位于金属元素和非金属元素交接区域,用来做良好的半导体材料;非金属可以制备有机溶剂,部分有机溶剂可以用来做农药;
一般为过渡金属元素可以用于做催化剂,比较容易.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基-1-丙醇和2-甲基-1-丁醇 | |
| B. | 对氯甲苯和邻氯甲苯 | |
| C. | 2-甲基丁烷和戊烷 | |
| D. | 甲基丙烯酸和甲酸丙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
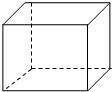 “立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示:
“立方烷”是一种人工合成的烃,其分子为正方体结构,其碳架结构如图所示: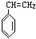 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族与ⅦA族元素间形成的化合物都是离子化合物 | |
| B. | 第三周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子从上到下还原性减弱 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.2C2H2(g)+0.5O2(g)═0.4CO2(g)+0.2H2O(g)△H=+259.92 kJ/mol | |
| B. | 0.2C2H2(g)+0.5O2(g)═0.4CO2(g)+0.2H2O(l)△H=-259.92 kJ/mol | |
| C. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+2599.2 kJ/mol | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599.2 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com