
 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.分析 (1)根据原子序数等于元素原子的核外电子数,再根据核外电子排布规律来写;
(2)碳碳单键和碳氢单键都是δ键,碳碳双键中一个是δ键,一个是π键;
(3)分子晶体的熔沸点较低;根据价层电子对互斥理论来分析解答,3个σ键且不含孤电子对采用sp2杂化,含有4个σ键且不含孤电子对采用sp3杂化;正负电荷重心重合为非极性分子,正负电荷重心不重合为极性分子,结合分子空间构型判断;
(4)Cr3+与C2O4 2-2、H2O存在配位键;
(5)利用均摊法确定该晶胞中各种离子的个数,结构铬原子配位键确定铬原子.
解答 解:(1)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)CH3COCH3分子中含有一个碳碳双键,6个碳氢键单键,2个碳碳键,所以含有1个π键,9个δ键;
故答案为:1;9;
(3)分子晶体的熔沸点较低,固态氯化铬酰的熔沸点较低,所以属于分子晶体;在丙酮分子中,羰基碳原子含有3个σ键且不含孤电子对,所以采用sp2杂化,甲基碳原子含有4个σ键且不含孤电子对,所以采用sp3杂化;二硫化碳是直线形分子,分子结构对称,正负电荷的中心重合,属于非极性分子,
故答案为:分子;sp2和sp3;非极性;
(4)K[Cr(C2O4)2(H2O)2]是配位化合物,Cr3+与C2O4 2-2、H2O存在配位键;
故答案为:配位;
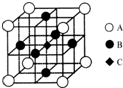
(5)该晶胞中B原子个数=6×$\frac{1}{2}$,A原子个数=8×$\frac{1}{8}$,C原子个数是1,且距离每个Cr原子最近的原子有6个,则c代表铬原子;
故答案为:c.
点评 本题综合考查物质的结构与性质知识,侧重于电子排布式、化学键、杂化类型与配位键等知识,题目难度中等,注意把握杂化类型的判断方法.


科目:高中化学 来源: 题型:填空题

| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol.L- 的Na2S2O3溶液滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 | K | L | M | N | 选项 |
| 19 | 2 | 8 | 9 | A | |
| 22 | 2 | 8 | 8 | 4 | B |
| 30 | 2 | 8 | 18 | 2 | C |
| 33 | 2 | 8 | 20 | 3 | D |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入稀有气体使压强增大,平衡将正向移动 | |
| B. | 增大Y的物质的量,X的转化率增大 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、SiO2、CO均为酸性氧化物 | |
| B. | 水泥、陶瓷、硅酸和水晶均为硅酸盐产品 | |
| C. | 烧碱、冰醋酸、四氯化碳均为电解质 | |
| D. | 漂白粉、水玻璃、氨水和汽油均为混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L CO2中所含原子数为NA | |
| B. | 常温常压下,9 g H2O含有电子数为5 NA | |
| C. | 标准状况下,22.4 L SO3中所含分子数为NA | |
| D. | 22 g CO2中所含共价键数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com