
����Ŀ���������ɱ���ϩΪԭ�Ϻϳ��л��߷��ӻ�����M��һ�ֺϳ�·��(���ַ�Ӧ����������������ȥ):

��֪:I.RCHBr-CH2Br![]() RC��CH
RC��CH
II.CH��CH+CH2=CH-CH=CH2![]()
III. 
��ش���������:
��1��D�Ľṹ��ʽΪ______��E�Ľṹ��ʽΪ________��
��2��C+D��E�ķ�Ӧ����Ϊ______��I�к��������ŵ�����Ϊ___________��
��3��H+I��M�Ļ�ѧ����ʽΪ___________��
��4���ڴ������������£�G��������Ӧ����Q(C9H8O3)��ͬʱ��������������Q��ͬ���칹����_____��(�����������칹)�����к˴Ź���������6�����շ�Ľṹ��ʽΪ____��
�ٳ������ⲻ��������״�ṹ
������FeCl3��Һ������ɫ��Ӧ
������NaHCO3��Һ��Ӧ����CO2
��5�����������ϳ�·�ߺ������Ϣ���Լ״���һ�Ȼ�����Ϊ�л�ԭ��(���Լ���ѡ)������Ʊ�������������ĺϳ�·��_____________________��
���𰸡� CH3��CH=CH��CH=CH2 ![]() �ӳɷ�Ӧ �ǻ�
�ӳɷ�Ӧ �ǻ� 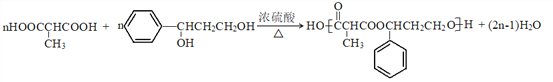 16
16 

����������1��������ϢIII��G��F�Ľṹ��ʽ���Է��Ƴ�E�Ľṹ��ʽ�ǣ� ������ϩ��A����Ӧ����B�Ľṹ��ʽ����
������ϩ��A����Ӧ����B�Ľṹ��ʽ����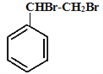 ����������ϢI�ƶϳ�C�Ľṹ��ʽ����
����������ϢI�ƶϳ�C�Ľṹ��ʽ����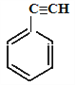 ��������ϢII��C��E�Ľṹ��ʽ�Ƴ�D�Ľṹ��ʽ�ǣ�CH3��CH=CH��CH=CH2 ������D�Ľṹ��ʽΪCH3��CH=CH��CH=CH2��E�Ľṹ��ʽΪ
��������ϢII��C��E�Ľṹ��ʽ�Ƴ�D�Ľṹ��ʽ�ǣ�CH3��CH=CH��CH=CH2 ������D�Ľṹ��ʽΪCH3��CH=CH��CH=CH2��E�Ľṹ��ʽΪ ��
��
��2��������ϢII�ɵã� ��C��+ CH3��CH=CH��CH=CH2��D��
��C��+ CH3��CH=CH��CH=CH2��D��![]()
 ��E��������C+D��E�ķ�Ӧ����Ϊ�ӳɷ�Ӧ��
��E��������C+D��E�ķ�Ӧ����Ϊ�ӳɷ�Ӧ��
G��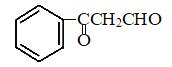 ��+H2
��+H2![]() I��
I��![]() ��������I�к��������ŵ�����Ϊ���ǻ���
��������I�к��������ŵ�����Ϊ���ǻ���
��3��F+O2��H������![]() ������F�Ľṹ��ʽ�ǣ�
������F�Ľṹ��ʽ�ǣ�![]() ��H+I��M�Ļ�ѧ����ʽΪ��
��H+I��M�Ļ�ѧ����ʽΪ��
��4��Q�ķ���ʽ��C9H8O3�������ⲻ��������״�ṹ
����FeCl3��Һ������ɫ��Ӧ��˵���ṹ���з��ǻ���-OH��������NaHCO3��Һ��Ӧ����CO2���ṹ�����Ȼ���-COOH�����ṹ��ֻ��һ���������������µ�2��̼ԭ����H�������һ����ϩ����-CH=CH2����������������ȡ�����Ľṹ��6��������ȡ�������ڡ��䡢������λ�ã��� ��
��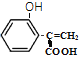 ������������ϩ�����ǻ����Ȼ�����ȡ�����Ľṹ��10��������ͬʱ����������Q(C9H8O3)��ͬ���칹����16�� �����ǻ���-OH���ͱ�ϩ�����-CH=CHCOOH���ڶ�λ�ϵĽṹ��6�ֲ�ͬ������Hԭ�ӣ����к˴Ź���������6�����շ壻��ṹ��ʽΪ��
������������ϩ�����ǻ����Ȼ�����ȡ�����Ľṹ��10��������ͬʱ����������Q(C9H8O3)��ͬ���칹����16�� �����ǻ���-OH���ͱ�ϩ�����-CH=CHCOOH���ڶ�λ�ϵĽṹ��6�ֲ�ͬ������Hԭ�ӣ����к˴Ź���������6�����շ壻��ṹ��ʽΪ�� ��
��
��5��������������Ǽ�������״�������Ӧ�IJ���״���֪����ν�һ�Ȼ�����ת��Ϊ�����ᣬ̼ԭ������ͬ�������Ų�ͬ������������ṩ����ϢIII��֪��̼̼˫�����Ա�����Ϊȩ����ȩ�����Ա�����Ϊ�Ȼ������Խ���ԭ��ȥ������ɺ�̼̼˫����ϩ��������±�������ڼ����������Ҵ��ͼ��������·�����ȥ��Ӧ�γ�̼̼˫���������Ʊ�������������ĺϳ�·�ߣ�


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�ij�ݻ��̶����ܱ������ɿ��ƶ��Ļ������� A��B ���ң��� A �г���һ���� H2��O2 �Ļ�����壬�� B �г��� 1 mol ��������ʱ������λ����ͼ��ʾ��

��1��A �һ����������ʵ���Ϊ______��������������Լ______��
��2��ʵ���� A �һ�����������Ϊ 34 g����û��������ܶ���ͬ��ͬѹ�����º����ܶȵ�______����
��3������ A �� H2��O2�Ļ�������ȼ�������ָ�ԭ�¶Ⱥ����ջ���ͣ����λ����______�̶ȣ�����������ѹǿ�뷴Ӧǰ����ѹǿ֮��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й�H��D��T��HD��H2��D����H������������˵����ȷ����
A.��Ϊͬλ��B.��������Ԫ��
C.HD��H2���ǵ���D.��������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E ���ֻ����������ij�ֳ���Ԫ�أ����ǵ�ת����ϵ��ͼ��ʾ������ A Ϊ������Һ��C Ϊ���ܵİ�ɫ���壬E ��������ˮ����ȡ A ��Һ���գ���ɫ��ӦΪ��ɫ(����ɫ�ܲ���)��
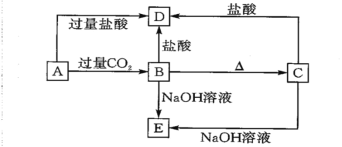
��ش��������⣺
(1)д����ѧʽ��A_____��B_____��C_____��D_____��E_____��
(2)д�����з�Ӧ�����ӷ���ʽ�� A��B��____ B��D��_____C��E��_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������������Ҫ��Ӧ�á�
��1�����백��ͬ����Ԫ�أ�������˵���߷ǽ�����ǿ������_______(����ĸ)��
a.NH3��PH3�ȶ���ǿ
b.�����£�����Ϊ���壬����Ϊ����
c.�������������ϱ������������ϸ�����
d.HNO3�����Ա�HPO3����ǿ
��2����ҵ��������[Ca5(PO4)3F]�����ᷴӦ�Ƹ����ᡣ��֪25�棬101kPaʱ:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ��H=-271kJ/mol
5CaO(s)+3H3PO4(l)+HF(g)=Ca5(PO4)F(s)+5H2O(l) ��H=-937kJ/mol
��Ca5(PO4)F�����ᷴӦ�Ʊ�������Ȼ�ѧ����ʽΪ________________��
��3����֪PCl5(g)![]() PCl3(g)+Cl2(g)��H>0���¶�ΪTʱ����һ������PCl5��������һ���ƿ�ڣ���Ӧ��ƽ���PCl5��PCl3�ķ�ѹ֮��Ϊ1:3(��ѹһ��ѹ�����ʵ�������)��
PCl3(g)+Cl2(g)��H>0���¶�ΪTʱ����һ������PCl5��������һ���ƿ�ڣ���Ӧ��ƽ���PCl5��PCl3�ķ�ѹ֮��Ϊ1:3(��ѹһ��ѹ�����ʵ�������)��
��PCl5�ķֽ���a1=_____%�����ﵽ�˺����ϵ��ѹΪ1.4MPa����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ��Ӧ��ƽ�ⳣ��Kp=_________��
���¶�ΪT2ʱ���µ�ƽ����ϵ��PCl5��Cl2��ѹ��ͬ����PCl5�ķֽ���a1________a2���¶�T1___T2(����>����<������=��)��
���ﵽƽ����������ʹPCl5�ֽ����������___________(����ĸ)��
a.�¶ȡ�������䣬������� b.������䣬����ϵ����
C.�¶ȡ�������䣬�������� d.�¶Ȳ��䣬�����������
��4������ˮ�ⷨ���������ķ�ˮ����Ҫ����H3PO4��H3PO3�ȣ����ȼ�������Ư�ۣ��ټ�����ʯ�ҵ���pH����Ԫ��ת��Ϊ����ĸ��γ��������ա�
���ڳ���ǰ�ȼ�������Ư�۵�������__________________��
����ͼ�Dz�ͬ�������ij��������ʵ�Ӱ��ͼ�����ó���ˮ����ƵĹ�������Ϊ______��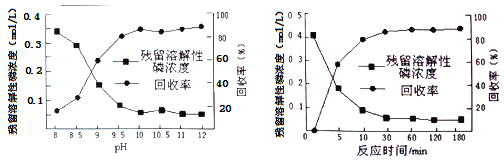
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������

��1����ˮ�������ɺ�ˮ��õ�ˮ�ij��÷���֮һ����ʵ���������һ������װ�ÿ϶� ��Ҫ���������е�һ���֣�����ʵ���������µ��ϡ������ҵ�˳��������__________ ������ţ���������������ˮӦ��________������a������b�����ڽ��롣
��2���������������ʾ����������Եõ���ˮ�����ӵ�ˮ����ȡ�⣬��Ҫ�������� �е�______������ţ�������������Ϊ__________����õ�ˮ�м������Ȼ�̼����ȡ�� ���ʵ�ʵ���������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ԫ��֮һ������ֲ���纣���������к��зḻ�ĵ�Ԫ�ء��غ���������ʳ�ú�������ˣ���״���״�ȵ�ȱ���������ʵ͡���֪����Ԫ���Ե����ӵ���ʽ���ڣ�������I���ܱ���ˮ����ΪI2��I2���л��ܼ��е��ܽ�����Դ�����ˮ�е��ܽ�ȣ�I2����ɫ����I������ɫ��ʵ������Ӻ�������ȡ���������ͼ��ʾ��
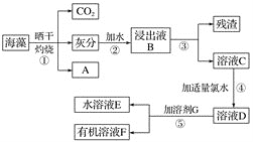
��1��д��A�Ļ�ѧʽ______________��
��2������۲�������Ҫ�IJ���������______________��______________��__________________��
��3�������л��ܼ��в�����Ϊ�ܼ�G����________(����������)��
A���ƾ�����B�����Ȼ�̼����C�����ᡡ��D.���͡���E.��
��4������ݵIJ���������__________����Һ����ҺE����ɫ����ҺF����ɫ______(����dz��)��
��5��������У���ѡ�ã�3���е�__________(����Һ����)Ϊ�ܼ�G����Һʱ��Ӧ�Ȱ���Һ____(�E����F��)�ӷ�Һ©�����²��ų���֮���ٰ���һ��Һ�ӷ�Һ©�����Ͽڵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��ȥ�����еĸ����ӡ�þ���ӡ���������Ӽ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽������������(���ڳ������Լ��Թ���)��

��1���ڢٲ��У�����A��__________���ڢݲ��У�����B��__________��
��2���ڢܲ��У�д����Ӧ�Ļ�ѧ����ʽ(�������Һ��Ca2������Ҫ������ʽΪ�Ȼ���)____________________________��
��3���������������Һ�����ԣ��ٹ��ˣ�����ʵ��������Ӱ�죬��ԭ����_________________________��
��4���ж��Ȼ����ѹ����ķ�����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��ͼ���о�������������Ӧ��ʵ��װ��ͼ��
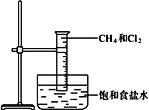
��1��������������Ӧ��������___________��
��2�����ȼ���_____________ͬ���칹�壨��С���û�С�����
��3�������һ�ȼ���������������Ӧ�Ļ�ѧ����ʽ��CH3Cl+Cl2![]() ________+HCl���÷�Ӧ���ڷ�Ӧ_________�����л���Ӧ���ͣ���
________+HCl���÷�Ӧ���ڷ�Ӧ_________�����л���Ӧ���ͣ���
��.��4��д�������л���Ľṹ��ʽ��
��2�������飺_____________
��1����ϩ��____________
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com