

| A. | M可能为铜,X可能为氯化铁 | B. | M可能为石墨,Y可能为硫酸铁 | ||
| C. | 电子由铁经盐桥流向M极 | D. | 盐桥中K+向铁极迁移 |
分析 已知Fe+2Fe3+═3Fe2+,根据反应可知Fe应为负极,失电子被氧化,正极可为C、Cu等,正极上Fe3+得电子生成Fe2+,电解质溶液含有Fe3+,原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应;电子负极流向正极,电流从正极流向负极;原电池中阳离子移向正极,阴离子移向负极,据此回答即可.
解答 解:A、已知Fe+2Fe3+═3Fe2+,根据反应可知Fe应为负极,失电子被氧化,正极M可为C、Cu等,正极上Fe3+得电子生成Fe2+,电解质溶液Y含有Fe3+,溶液X含有Fe2+,故A错误;
B、正极M可为C、Cu等,正极上Fe3+得电子生成Fe2+,电解质溶液Y含有Fe3+,故B正确;
C、电子负极流向正极,但是只能沿着导线走,电子不会经过电解质,故C错误;
D、盐桥中K+向正极M极迁移,故D错误.
故选B.
点评 本题考查了原电池的设计和工作原理的探究,为侧重于基础知识的考查,题目难度不大,注意把握原电池的组成和原理,学习中注意基础知识的积累.


科目:高中化学 来源: 题型:填空题
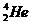 ;
;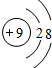 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸带过滤嘴的香烟,对人体无害 | |
| B. | 人工合成的具有生命活性的蛋白质-结晶牛胰岛素,是1965年我国科学家最先合成的 | |
| C. | 纯天然物质配成的饮料,不含任何化学物质 | |
| D. | 蒸馏水绝对纯净,其中不含任何分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | K+、H+、SO42-、OH- | B. | Na+、Ba2+、CO32-、NO3- | ||
| C. | Na+、H+、Cl-、NO3- | D. | Mg2+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
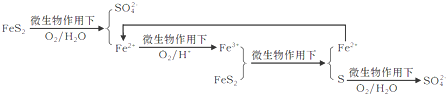
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碘食盐中碘以单质形式存在 | |
| B. | NaHCO3可以与胃酸反应,用来治疗胃酸过多 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化、杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烯烃各同系物中碳的质量分数相等 | |
| B. | C2H4和C4H8一定是同系物 | |
| C. | 分子量相同的两种物质不一定是同分异构体 | |
| D. | C2H6和C4H10一定是同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com