
| A.白色沉淀→沉淀增加 |
| B.白色沉淀→沉淀增加→部分溶解 |
| C.白色沉淀→沉淀随即溶解→澄清溶液 |
| D.白色沉淀→沉淀随即溶解→不再溶解→沉淀增加 |


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.(4n-m) mol | B.(4m-n) mol |
| C.(n-3m)mol | D.(3m-n)mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
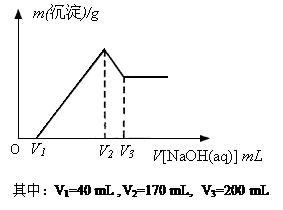
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一部分为Al(OH)3,一部分为Al3+ |
| B.一部分为Al(OH)3,一部分为AlO2- |
| C.全部是Al(OH)3 |
| D.全部是AlO2- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HNO3溶液 | B.Ba(OH)2溶液 |
| C.H2SO4溶液 | D.HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com