
����Ŀ���������ͭ( II )��ؾ���{K2[Cu(C2O4)2]��2H2O}��������ˮ����������ˮ�����ھƾ�������ʱ��Ϊ�ȶ�������ʱ�ֽ⡣
I.������ͭ�Ͳ���Ϊԭ���Ʊ��������ͭ(II)��ؾ�����������£�
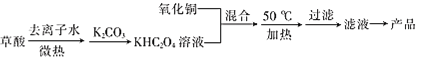
��֪��H2C2O4![]() CO��+CO2��+H2O
CO��+CO2��+H2O
�ش��������⣺
(1)��H2C2O4�������ȥ����ˮ�У��ȣ��ܽ�������¶Ȳ���̫�ߣ�ԭ����________��
(2)��CuO��KHC2O4�Ļ��Һ��50��C�³�ַ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ__________��
(3)50 ��Cʱ����������Ӧ��ֺ�IJ�����_______________(����ĸ)��
A.���ڱ�ˮ����ȴ����� B.��Ȼ��ȴ�����
C.���ȹ��� D.����Ũ������ȴ�����
II.��CuSO4��5H2O�����K2C2O4����Ϊԭ���Ʊ��������ͭ( II )��ؾ��塣
ʵ�鲽�裺��CuSO4��5H2O�����K2C2O4����ֱ���ȥ����ˮ�ܽ��K2C2O4��Һ��μ�������ͭ��Һ�У��о�����������ڱ�ˮ����ȴ�����ˣ��þƾ�ϴ�ӣ���ˮԡ���ϳ��ɡ���ʱ���Ͻ��裬�õ���Ʒ��
(4)�þƾ���������ˮϴ�ӵ�Ŀ����____________��
II.��Ʒ���ȵIJⶨ��ȷ��ȡ�Ƶõľ�������ag����NH3��H2O�У�����ˮ������250mL��ȡ������Һ25.00mL���ټ���10 mL��ϡ���ᣬ��b mol��L-1 ��KMnO4��Һ�ζ�������KMnO4��ҺV mL��
(5)�ζ�ʱ�����еζ���ʽ�У����������______(����ĸ)������Ϊ________�� (�гֲ�����ȥ)
A. 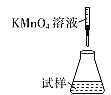 B.
B. 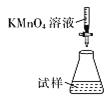 C.
C. 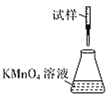
(6)���ڽӽ��ζ��յ�ʱ������������ˮ����ƿ�ڱڳ�ϴһ�£��ټ����ζ����յ㣬ʵ������_____(����ƫ����ƫС��������Ӱ����)��
(7)�ò�Ʒ�Ĵ���Ϊ___________(д������ʽ)��
���𰸡��¶ȹ��߲����ֽ� 2KHC2O4+CuO![]() K2[Cu��C2O4��2]+H2O C �ƾ��ӷ������ڸ���������ͭ( II )��ؾ��� B �ζ�ʱ����ҺӦʢ���ڵζ����У�����ҺӦʢ������ƿ�У��������Ϊǿ��������ҺӦʹ����ʽ�ζ��� ��Ӱ��
K2[Cu��C2O4��2]+H2O C �ƾ��ӷ������ڸ���������ͭ( II )��ؾ��� B �ζ�ʱ����ҺӦʢ���ڵζ����У�����ҺӦʢ������ƿ�У��������Ϊǿ��������ҺӦʹ����ʽ�ζ��� ��Ӱ�� ![]()
��������
�������ᾧ���ˮ���ȿɼӿ췴Ӧ���ʣ���Ҫ�����¶ȹ��߲���ֽ⣬Ȼ�����̼��ع��壬������KHC2O4����������ͭ�����Һ��50��ˮԡ���ȣ�Ϊ��ֹ�����������ȹ��ˣ���Һ������Ũ������ȴ�ᾧ�ɵõ�K2[Cu��C2O4��2]2H2O��
��1��������Ŀ������ϢH2C2O4![]() CO��+CO2��+H2O��֪�¶ȹ���ʹ����ֽ⣻
CO��+CO2��+H2O��֪�¶ȹ���ʹ����ֽ⣻
��2�����������֪��CuO��KHC2O4��Һ��50��ˮԡ���������·�Ӧ����K2[Cu��C2O4��2]��H2O����Ӧ�ķ���ʽΪ��2KHC2O4+CuO![]() K2[Cu��C2O4��2]+H2O��
K2[Cu��C2O4��2]+H2O��
��3��������Ŀ��Ϣ��֪{K2[Cu(C2O4)2]��2H2O}������ˮ����������ˮ�����Գ�ַ�Ӧ��Ӧ���ȹ��ˣ���߲��ʣ�����ѡC��
��4��{K2[Cu(C2O4)2]��2H2O}���ھƾ��������þƾ�ϴ��Ҳ���Լ��پ������ʧ��ͬʱ����ˮ��Ⱦƾ��ӷ������ڸ���������ͭ( II )��ؾ��壻
��5���ζ�ʱ����ҺӦʢ���ڵζ��������ҺӦʢ������ƿ�У��������Ϊǿ��������ҺӦʹ����ʽ�ζ��ܣ����¿�Ϊ�����ĵζ��ܣ���������ʵ�ӦΪB��
��6���õζ�������ͨ�������������Һȷ���������ͭ( II )��ؾ�������ʵ�������ƿ����ˮ�Եζ�û��Ӱ�죻
��7���ζ�������{K2[Cu(C2O4)2]��2H2O}��CԪ�ر���������CO2��ÿ��C���ϼ�����1�ۣ�������4�ۣ�KMnO4�е���Ԫ�ر���ԭ����Mn2+�����ϼ۽���5�ۣ����Դ���������ϵ5{K2[Cu(C2O4)2]��2H2O}~4 KMnO4����n��K2[Cu(C2O4)2]��2H2O��= V��10-3L��bmol��L-1��![]() ��
��![]() =12.5Vb��10-3mol�����Բ�Ʒ�Ĵ���Ϊ
=12.5Vb��10-3mol�����Բ�Ʒ�Ĵ���Ϊ![]() =
=![]() ��
��


 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2 L���ݾ���(������罻������)�����н���2A(g) +B(g) =2C(g)+D(s)��Ӧ�����±�����Ͷ�ϣ���Ӧ10 s��ﵽƽ��״̬�������ϵѹǿ���ߣ�ǰ10s��v(A)= 0.025 mol/(Ls)������˵����ȷ����

A. ��ƽ��ʱ,2v����A��=v��(B) B. ƽ�������D����,ƽ�������ƶ�
C. ����ƽ��ʱ��n(B) =0.5 mol D. �¶����ߣ��÷�Ӧ��ƽ�ⳣ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ļ��������[(CH3)4NOH]���������ӹ�ҵ��ϴ�������ļ��Ȼ��[(CH3)4NCl]ˮ��ҺΪԭ�ϣ�ͨ����ⷨ�Ʊ�(CH3)4NOH���乤��ԭ����ͼ��ʾ������˵����ȷ���ǣ� ��
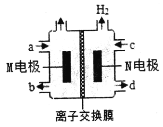
A.M�缫�ĵ缫��ӦʽΪ��4OH-��4e-=O2��+2H2O
B.N�缫�ӵ�Դ������
C.������ͨ�����ӽ���Ĥ��M�缫�ƶ�
D.�Ʊ�18.2g(CH3)4NOH������������4.48L����(��״��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Һ���ּƻ�2020��ʵʩ����̽�������˽�����ϴ��ڴ����ĺ����������ѧ���Ʋ��������������Ҫ�Ե���̼���衢ͭΪ���幹�ɡ�
��ش��������⣺
��1���ڰ������(![]() )��ͭ��̨�����л����Գƺϳ�������յ�ЧӦ��
)��ͭ��̨�����л����Գƺϳ�������յ�ЧӦ��
���ڰ������������Ԫ�صĵ縺�Գ�С�����˳��Ϊ__(��Ԫ�ط���)����NAΪ�����ӵ�������ֵ��1mol![]() �к�����������ĿΪ__��
�к�����������ĿΪ__��
��һ��������-NH2���Ա�������-NO2��-NO2��Nԭ�ӵ��ӻ���ʽΪ__�ӻ���
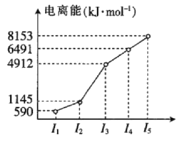
��2���������ڵ�ij����Ԫ�أ����һ�����������������ͼ��ʾ�����Ԫ�صĻ�̬ԭ�ӵ����Ų�ʽΪ___��
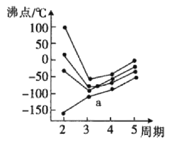
��3��Ԫ�����ڱ��еĵ�IVA��~��VIIA���в���Ԫ�ص�����⻯��ķе�仯��������ͼ������һ��С�ڵ����-���⻯���������a������__��Ԫ�ص�����⻯��ķе�仯���ƣ��ж�������__��
��4���ɱ��dz����ķ��Ӿ��壬��CO2�ڸ��¸�ѹ�����γ���һ�־����侧����ͼ��ʾ����CO2������۵�__(����>����<������=��)SiO2������۵㡣
��5��һ�����ʺ�һ����वĽṹ��ͼ��
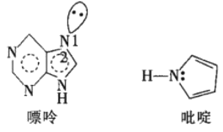
�������й��֮��ļнǡ�1�ȡ�2��ԭ����__��
�ڷ����еĴ����������÷���![]() ��ʾ������m���������γɴ�������ԭ������n���������γɴ������ĵ��������������еĴ������ɱ�ʾΪ__��
��ʾ������m���������γɴ�������ԭ������n���������γɴ������ĵ��������������еĴ������ɱ�ʾΪ__��
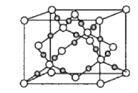
��6��������ʯ�д��ڴ����ĵ����أ�������Ϊ�����������ṹ��ͼ��ʾ�����þ����ܶ�Ϊdg��cm-3����������a=b��c(��λ��nm)��a��b�н�Ϊ120���������ӵ�������ֵΪNA��������c=___nm(д������ʽ)��
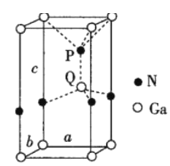
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����Ƶ�һ��ʹɳĮ�������¼���������ɳĮ������һ����![]() ���۱�ϩ��������ˮ�Ļ���ʹ����ɳ����ϣ��γɼ�����ֹ���µ��η��������������ء������ˮ���á����жԾ۱�ϩ��������������ȷ���ǣ� ��
���۱�ϩ��������ˮ�Ļ���ʹ����ɳ����ϣ��γɼ�����ֹ���µ��η��������������ء������ˮ���á����жԾ۱�ϩ��������������ȷ���ǣ� ��
A.�۱�ϩ�����ĵ���ṹʽΪCH3��CH2COORB.�۱�ϩ�����й̶����۷е�
C.�۱�ϩ�����ܷ����ӳɷ�ӦD.�ϳɾ۱�ϩ�����ķ�Ӧ���ڼӾ۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������4����ѧ��Ӧ�У�������3����Ӧ���Ͳ�ͬ����(����)
A. CH3CHO��2Cu(OH)2![]() CH3COOH��Cu2O����2H2O
CH3COOH��Cu2O����2H2O
B. CH3CH2OH��CuO![]() CH3CHO��Cu��H2O
CH3CHO��Cu��H2O
C. 2CH2=CH2��O2![]() 2CH3CHO
2CH3CHO
D. CH3CH2OH��HBr��CH3CH2Br��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ���NaBr��ŨH2SO4���Ҵ�Ϊԭ���Ʊ����������飺
C2H5��OH+HBr![]() C2H5Br+H2O
C2H5Br+H2O
��֪��Ӧ�������Ϊ��0.30 mol NaBr��s����0.25 mol C2H5OH���ܶ�Ϊ0.80 g��cm-3����36 mLŨH2SO4����������Ϊ98%���ܶ�Ϊ1.84 g��mL-1����25 mLˮ���Իش��������⡣
��1����ʵ��Ӧѡ��ͼ�е�aװ�û���bװ�ã�_____________��
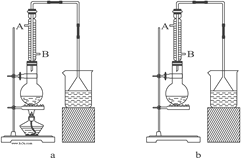
��2����Ӧװ���е���ƿӦѡ���������ֹ���������_____��
A.50 mL B.100 mL C.150 mL D.250 mL
��3���������е�����ˮ������Ӧ����_____��
A. A��B�� B. B��A�� C. ��A����B������
��4�����ܷ����ĸ���ӦΪ��_____________��__________��______________������д��3������ʽ����
��5��ʵ����ɺ��뽫��ƿ�ڵ��л�������������õ��ػ�ɫ�Ĵ������飬���ô��������飬Ӧ���õĴ�ʩ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�dz��㷺���ش��������⣺
��1����̬�ࣨSb��ԭ�Ӽ۵����Ų��Ĺ��ʽΪ____��[H2F]+[SbF6]���������ࣩ��һ�ֳ�ǿ�ᣬ����[H2F]+�������ӵĿռ乹��Ϊ______������д��һ����[H2F]+������ͬ�ռ乹�ͺͼ�����ʽ�ķ��Ӻ������ӷֱ���_______��_________��
��2�����ᣨH3BO3�����ķ�����泥�NH4BF4����������Ҫ�Ļ�����;��
��H3BO3��NH4BF4�漰������Ԫ���еڶ�����Ԫ�صĵ�һ�������ɴ�С��˳��_____����Ԫ�ط��ţ���
��H3BO3�������ܵ����H+����ˮ�����һ��OH������[B(OH)4]���������������ԡ�[B(OH)4]����Bԭ�ӵ��ӻ�����Ϊ_____��
��NH4BF4���ķ�����泥�����������ͭ�������ۼ����ܸ�ʴ�����ȡ��ķ�������д���_______������ţ���
A ���Ӽ� B �Ҽ� C �м� D ��λ�� E ���»���
��3��ij�����Ͻ�ľ�����ͼ��ʾ���谢���ӵ�������ֵΪ![]() ���þ�����ܶȦ�_________g��cm��3��
���þ�����ܶȦ�_________g��cm��3��
 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�������з����踺������ӵ�أ�����ͬ����У��踺�����������ʯī̼�����������25%����Ӧԭ��Ϊ5LiMn2O4+Si![]() 5Li0.12Mn2O4+Li4.4Si��LiPF6��Һ��������ʣ������й�˵����ȷ���ǣ� ��
5Li0.12Mn2O4+Li4.4Si��LiPF6��Һ��������ʣ������й�˵����ȷ���ǣ� ��
A.�ŵ�ʱ�ĸ�����ӦΪLi��e��=Li+
B.���øõ�ص��ˮ����������3.52gO2����õ�ظ�����������0.77g
C.����ӵ�س��ʱ��������ӦΪSi+4.4e-+4.4Li+=Li4.4Si
D.�ŵ�ʱ�����LiPF6ˮ��Һ�е�Li+��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com