
【题目】如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,回答下问题:

(1)惰性电极Ⅰ为电解池的__________(选填“阴”或“阳”,下同)极。
(2)反应开始一段时间后,惰性电极Ⅰ上实验现象为______________________KI—淀粉溶液会变__________色。
(3)惰性电极Ⅱ上发生的电极反应为__________________________
(4)该电解反应方程式为____________________________________
(5)可以将惰性电极Ⅰ换为______________
A.铜棒 B.铁棒 C.钠块
【答案】阴 析出红色物质 蓝 2Cl--2e- = Cl2↑ CuCl2 ![]() Cu + Cl2↑ 或 Cu2++2Cl-
Cu + Cl2↑ 或 Cu2++2Cl- ![]() Cu + Cl2↑ AB
Cu + Cl2↑ AB
【解析】
⑴电极II是产生气体,且用KI—淀粉溶液来检验,因此II是产生氯气,惰性电极Ⅰ为电解池的阴极、II为阳极。
⑵反应开始一段时间后,惰性电极Ⅰ为阴极,铜离子得到电子变为铜单质,因此实验现象为析出红色物质,KI—淀粉溶液会变蓝色。
⑶惰性电极Ⅱ上是氯离子得到电子,电极反应为2Cl--2e- = Cl2↑。
⑷该电解反应方程式为CuCl2 ![]() Cu + Cl2↑或 Cu2++2Cl-
Cu + Cl2↑或 Cu2++2Cl- ![]() Cu + Cl2↑。
Cu + Cl2↑。
⑸Ⅰ是阴极,因此可以将惰性电极Ⅰ换为一般的金属,但不能换成与水能反应的金属。
⑴II是产生气体,用KI—淀粉溶液来检验,因此II是产生氯气,惰性电极Ⅰ为电解池的阴极,故答案为:阴。
⑵反应开始一段时间后,惰性电极Ⅰ为阴极,是铜离子得到电子变为铜单质,因此实验现象为析出红色物质,KI—淀粉溶液会变蓝色,故答案为:析出红色物质;蓝。
⑶惰性电极Ⅱ上是氯离子得到电子,电极反应为2Cl--2e- = Cl2↑,故答案为:2Cl--2e- = Cl2↑。
⑷该电解反应方程式为CuCl2 ![]() Cu + Cl2↑ 或 Cu2++2Cl-
Cu + Cl2↑ 或 Cu2++2Cl- ![]() Cu + Cl2↑,故答案为:CuCl2
Cu + Cl2↑,故答案为:CuCl2 ![]() Cu + Cl2↑ 或 Cu2++2Cl-
Cu + Cl2↑ 或 Cu2++2Cl- ![]() Cu + Cl2↑。
Cu + Cl2↑。
⑸Ⅰ是阴极,因此可以将惰性电极Ⅰ换为一般的金属,但不能换成与水能反应的金属,故答案为:AB。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:
【题目】醋酸与醋酸钠组成的缓冲溶液对酸碱有一定的缓冲作用,缓冲能力与组分的浓度有关。室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1 mol·L1 CH3COOH溶液:c(CH3COOH)> c(CH3COO-) > c(H+)>c(OH-)
B.pH=8的CH3COOH和CH3COONa混合溶液:c(Na+)﹣c(CH3COO-) =9.9×10-7 mol·L-1
C.0.1 mol·L1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)= 3c(CH3COO-)+3c(CH3COOH)
D.0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙,甲是常见温室效应气体。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物,其转化关系如图所示。下列判断不正确的是
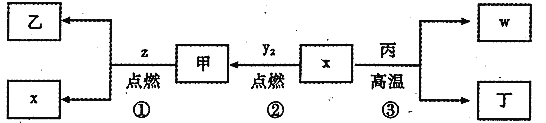
A.反应①②③都属于氧化还原反应B.X、Y、Z、W四种元素中,W的原子半径最大
C.在信息工业中,丙常作光导纤维材料D.一定条件下,x与甲反应生成丁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用平衡移动原理解释的是( )
A.铁触媒有利于合成氨反应
B.夏天开启啤酒瓶盖后,瓶中立刻泛起大量泡沫
C.对装有N2O4和NO2混合气体的密闭烧瓶加热,颜色变深
D.合成氨反应:![]()
![]()
![]() ,为使氨的产率提高,理论上应采取低温高压的措施
,为使氨的产率提高,理论上应采取低温高压的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.05molSO2(g)和0.03molO2(g)放入容积为1L的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
2SO3(g),在一定条件下达到平衡,测得c(SO3)=0.04mol·L-1。以下表述正确的是
A.该条件下反应的平衡常数为1.6×103
B.通常情况下,该反应一定能自发进行
C.题给条件下,O2的转化率是20%
D.当体系中SO2和SO3的速率之比是1:1时,则该反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,说明该反应的△H<0
B. 加水稀释0.1mol·L-1的CH3COONa溶液后,溶液中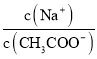 的值增大
的值增大
C. 氟元素的非金属性强于溴元素,由此可推出酸性:HF>HBr
D. 用等物质的量浓度的NaOH溶液中和等体积且pH均为2的盐酸和醋酸溶液,盐酸消耗的NaOH溶液体积更多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是![]()
A.![]() 的溶液不一定呈中性
的溶液不一定呈中性
B.除去氯化镁溶液中的氯化铁杂质,可加入碳酸镁调节pH
C.强碱滴定弱酸可选用酚酞作指示剂,滴定终点现象是无色突变为粉色
D.![]() 时,某溶液中由水电离产生的
时,某溶液中由水电离产生的![]() ,该溶液
,该溶液![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有室温下四种溶液,有关叙述不正确的是( )
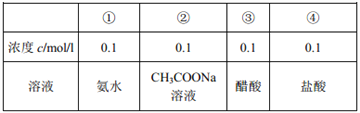
A. 
20 mL (1)溶液中逐滴加入(3)溶液,溶液导电能力变化如图
B. (2)、(3)两溶液等体积混合,离子浓度: 2c(Na+)= c(CH3COO-)+ c(CH3COOH)
C. (1)、(4)两溶液等体积混合,离子浓度:c(Cl-)>c(NH4+)>c(H+) >c(OH-)
D. 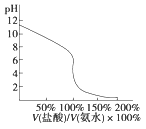
用(4)滴定(1),滴定曲线如图,可用酚酞作指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨为重要化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+216.4KJ/mol
CO(g)+3H2(g) △H=+216.4KJ/mol
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.2kJ/mol
CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H=______。
CO2(g)+4H2(g) △H=______。
(2)起始时投入氮气和氢气分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度关系如图。
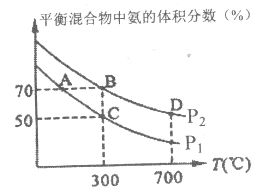
①恒压时,反应一定达到平衡状态的标志是______(填序号):
A.N2和H2的转化率相等 B.反应体系密度保持不变
C.![]() 的比值为3:2 D.
的比值为3:2 D.![]() =2
=2
②P1______P2(填“>”、“<”、“=”,下同):反应平衡常数:B点______D点;
③C点H2的转化率______;(数值保留0.1%)在A、B两点条件下,该反应从开始到平衡时生成氢气平均速率:v(A)______v(B)(填“>”、“<”、“=”)。
(3)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为______________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com