
分析 n(Cl2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,n(HCl)=12mol/L×0.2L=2.4mol,
(1)根据转移电子守恒计算二氧化锰质量;
(2)参加反应的浓盐酸中只有一半的HCl被氧化,根据Cl原子守恒计算被氧化的HCl物质的量;
(3)根据Cl原子守恒计算剩余氯离子物质的量,根据C=$\frac{n}{V}$计算反应后氯离子浓度.
解答 解:n(Cl2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,n(HCl)=12mol/L×0.2L=2.4mol,
(1)根据转移电子守恒得m(MnO2)=$\frac{0.15mol×2}{(4-2)}×87g/mol$=13.05g,
答:需要消耗二氧化锰质量为13.05g;
(2)参加反应的浓盐酸中只有一半的HCl被氧化,根据Cl原子守恒得被氧化的n(HCl)=2n(Cl2)=2×0.15mol=0.3mol,答:被氧化的HCl的物质的量是0.3mol;
(3)根据Cl原子守恒得剩余n(Cl-)=2.4mol-0.15mol×2=2.1mol,C(Cl-)=$\frac{n}{V}$=$\frac{2.1mol}{0.2L}$=10.5mol/L,
答:反应后溶液中Cl-物质的量浓度是10.5mol/L.
点评 本题考查化学反应方程式有关计算,为高频考点,侧重考查分析计算能力,利用原子守恒、转移电子守恒分析解答,题目难度不大.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.
A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.
如图是一个化学过程的示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生石灰用作食品抗氧化剂 | |
| B. | Cl2+2Br-═2Cl-+Br2、Zn+Cu2+═Zn2++Cu均为单质被还原的置换反应 | |
| C. | 将KI和FeCl3溶液在试管中混合后,加入CCl4振荡、静置,下层溶液显紫红色,氧化性:Fe3+>I2 | |
| D. | 用含硅胶,铁粉的透气小袋与食品一起密封包装,这个过程不涉及化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
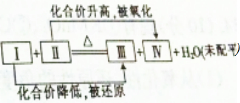 一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )
一个化学反应体系中含有浓H2SO4,Cu,H2O,CuSO4,SO2 5种物质,其发生反应的化学方程式可用如图表示,则Ⅳ处的物质是( )| A. | H2SO4 | B. | CuSO4 | C. | Cu | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com