
| A、能使甲基橙显红色的溶液中,Ba2+、Fe2+、Cl-、NO3-可以大量共存 |
| B、钢铁发生吸氧腐蚀的正极反应:O2+4e-+4H+=2H2O |
| C、常温下,由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3-可以大量共存 |
| D、NaHCO3溶液中滴入少量Ca(OH)2溶液:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、10% | B、大于10% |
| C、小于10% | D、5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有机物一定都含碳、氢元素 |
| B、分子中含有羟基的化合物属于醇类 |
| C、分子式相同,各元素质量分数也相同的物质是同种物质 |
| D、有机物分子中,氢原子数不一定都是偶数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
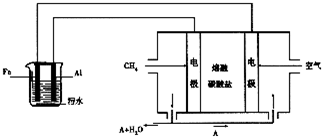 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示:
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 事实 | 解释或结论 | |
| ① | 常温下钢、铝均不溶于浓硫酸 | 常温下钢、铝与浓硫酸均不反应 |
| ② | 测定同浓度的Na2CO3溶液pH的小于Na2SiO3溶液的pH | 水解程度:CO32-<SiO32- |
| ③ | 氯水点到蓝色石蕊试纸先变红后褪色 | 氯水中含有H+有酸性、Cl2有漂白性 |
| ④ | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2? |
| A、①②③④ | B、①③ | C、②③ | D、① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| A、①② | B、②③ | C、③④ | D、①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com