
 Cu+Cl2↑
Cu+Cl2↑

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 氢气是一种清洁能源,可以通过多种方法制得.
氢气是一种清洁能源,可以通过多种方法制得.| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡. | 溶液出现棕黄色 | 2IO3-+5HSO3-═I2+5SO42-+3H++H2O 2IO3-+5HSO3-═I2+5SO42-+3H++H2O |
| 3.再向上述溶液中滴加淀粉溶液,振荡. | 溶液变成蓝色 | 淀粉遇碘变蓝 淀粉遇碘变蓝 |
| ||
查看答案和解析>>
科目:高中化学 来源:2012届北京市朝阳区高三上学期期中考试化学试卷 题型:填空题
(13分)氢气是一种清洁能源,可以通过多种方法制得。
(1) 工业上用水煤气法制氢气,有关化学方程式是:
反应一:C( s) + H2O(g)
s) + H2O(g)  CO(g) + H2(g) △H> 0
CO(g) + H2(g) △H> 0
反应二:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0
CO2(g) + H2(g) △H < 0
①若反应一在t℃时达到化学平衡状态,则此温度下该反应的的平衡常数表达式
K = ;
②在427℃时将CO 和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状态,该反应的平衡常数是9,则CO的转化率是 ,用CO的浓度变化表示的反应率速v(CO)是 mol /(L·min)。
(2)利用电解饱和食盐水也可制得氢气,下图为电解食盐水的示意图: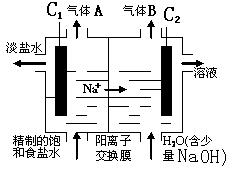
请回答:
① C1电极是 极(填“阴”或“阳”),C2电极的电极反应式是 。
②该电解反应的离子方程式是 ,
(3)通过下列方法也可以得到氢气。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-247.4 kJ·mol-1
1molCH4(g)与H2O(g)反应生成CO2(g)和H2(g)的反应热是 kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(14分)在现代生活中,人们越来越注意微量元素的摄入。碘元素对人体健康有着至关重要的作用。为预防碘缺乏病,我国卫生部规定每千克食盐中应含有40~50mgKIO3。下表是某超市出售的加碘精制盐的有关说明:
产品标准 | GB5461 2000 |
配料表 | 氯化钠、碘酸钾、抗结剂 |
氯化钠含量 | ≥98.5% |
含碘量(以I计) | 20~50mg/kg |
储藏方法 | 密闭、避光、防潮 |
食用方法 | 待食品熟后加入 |
包装日期 | 见打印批号 |
某同学设计实验验证此食盐中是否含碘和检查该食盐是否为合格产品。
(1)完成下列实验报告:
实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡。 | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡 | 溶液出现棕黄色 |
|
3.再向上述溶液中滴加淀粉溶液,振荡 | 溶液变成蓝色 |
|
(2)加碘食盐的包装袋上标有食用方法:待食品熟后加入。其原因是:
(3)该同学取该食盐样品100.0g完全溶解于水中,然后加入用盐酸酸化的淀粉―KI溶液,结果溶液呈蓝色,则反应的离子方程式为 。
为进一步确证样品是否为合格产品,该同学又用0.010mol?L-1的Na2S2O3溶液滴定,当用去12.00mL时蓝色刚好褪去(反应方程式为I2+2S2O2-3=2I-+S4O2-6),通过计算核加碘食盐中KIO3的含量为 mg/kg。由此可判定该食盐为 (填“合格”或“不合格”)产品。
(4)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O ===== KIO3+3H2↑,则阳极的电极反应式为 ;阴极附近pH值 (填“增大”、“减小”、“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com