
分析 (1)已知:①CO(g)+2H2(g)?CH3OH(g)△H
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41kJ/mol
根据盖斯定律,②-③=①,据此计算;
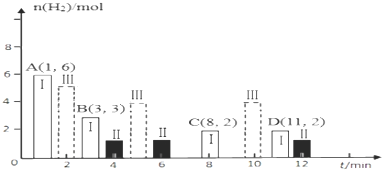
(2)①根据图象可知,反应在8min达到平衡,此时氢气的物质的量为2mol,列三段式,计算化学平衡常数K;
②Ⅱ在4min达到平衡,且平衡时氢气的物质的量比Ⅰ小,说明反应速率加快,且平衡正向移动,再根据影响化学平衡的因素分析可得;
③状态Ⅲ反应速率快,平衡时氢气的物质的量较Ⅰ大,说明平衡逆向移动,故温度升高了;
④根据温度对化学平衡的移动可得K的大小;
⑤可逆反应平衡时,正逆反应速率相等,各组分含量保持不变,据此分析.
解答 解:(1)已知:①CO(g)+2H2(g)?CH3OH(g)△H
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H=+41kJ/mol
根据盖斯定律,②-③=①,则①中的△H=-58kJ/mol-41kJ/mol=-99kJ/mol;
故答案为:-99;
(2)①T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,根据图象可知,反应在8min达到平衡,此时氢气的物质的量为2mol,列三段式:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始(mol/L):3 4 0 0
转化(mol/L):1 3 1 1
平衡(mol/L):2 1 1 1
则反应②的平衡常数K=$\frac{1×1}{2×{1}^{3}}$=0.5;
故答案为:0.5;
②从图象可知:Ⅱ在4min达到平衡,说明反应速率加快,可为升高温度,加催化剂,增大压强,平衡时氢气的物质的量比Ⅰ小,说明平衡正向移动,该反应放热反应,升高温度,平衡逆向移动,催化剂不影响平衡,该反应是个气体体积减小的反应,增大压强,平衡正向移动,则应该是增大压强;
故答案为:增大压强;
③根据图象,状态Ⅲ达到平衡呢所用时间短,反应速率较快,平衡时氢气的物质的量也较大,说明反应逆向移动,故应温度较T℃高;
故答案为:>;
④状态Ⅱ增大压强,温度不变,仍为T℃,状态Ⅲ温度比T℃高,该反应是正反应是放热反应,温度升高,平衡逆向移动,化学平衡常数减小,K2>K3;
故答案为:>;
⑤反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-58kJ/mol在恒容容器中进行,
a.甲醇和水蒸气作为生成物,体积比始终未1:1保持不变,故a错误;
b.反应气体体积减小,恒容时,随着反应的进行,压强减小,平衡后,容器中压强保持不变,故b正确;
c.v正(H2)=3v正(CH3OH)=3v逆(CH3OH),正逆反应速率相等,反应平衡,故c正确;
d.任何时刻,2个C=O断裂的同时都有6个H-H断裂,故d错误;
故答案为:b c.
点评 本题考查了盖斯定律、化学平衡常数的计算,影响化学平衡的因素以及化学平衡状态的判断,题目难度不大,重在考查对基础知识的理解掌握.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 现有如下药品和装置:质量为w(w<1g)的锌片、稀H2SO4、无水硫酸铜和蒸馏水,设计一个简单实验,测定Zn的相对原子质量(气体体积均可认为是在标准状况下测定)如图
现有如下药品和装置:质量为w(w<1g)的锌片、稀H2SO4、无水硫酸铜和蒸馏水,设计一个简单实验,测定Zn的相对原子质量(气体体积均可认为是在标准状况下测定)如图查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com