
【题目】燃煤烟气中含有大量NOx和SO2,可经处理消除。
(1)用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+ 4NO2(g) 4NO(g)+CO2(g)+ 2H2O(g); H1=574.0 kJ ·mol-1
CH4(g)+4NO(g) 2N2(g)+ CO2(g)+ 2H2O(g); H2= 1160.0 kJ·mol-1
①反应CH4(g)+2NO2(g) N2(g)+CO2(g)+ 2H2O(g); H3=_____;
②若该反应中将NOx还原为N2,消耗标准状况下5.6L CH4,则反应过程中转移的电子物质的量为___;
(2)用CH4原NO2的反应为CH4(g)+ 2NO2(g) N2(g)+CO2(g)+ 2H2O(g),向两个容积均为2L温度分别为T1°C、T2°C的恒温恒容密闭容器中分别加入物质的量为1 mol的CH4和2molNO2,测得各容器中n(NO2)随反应时间t的变化如图所示:

①T1_______T2(填“>”或“<”);
②T1°C时,40~80 min,用N2的浓度变化表示的平均反应速率为v(N2)=_____,此温度下的化学平衡常数K=______;
③T1°C下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,化学平衡_____移动(填“正向”、 “逆向”或“不”);
(3)亚氯酸钠(NaClO2)和次氯酸钠(NaClO)碱性混合液作为复合吸收剂可脱除烟气中的NOx、SO2,使其转化为NO3-、SO42-。
①写出NO与NaClO2反应的离子方程式:__________________________;
②下图表示在一定条件下温度与复合吸收剂对烟气中SO2、NO脱除效率的关系。图中SO2比NO脱除效率高的原因可能是____________________________ ( 答出一点即可);

(4)用碱液脱硝是目前研究的课题之一。
①将NO、NO2 控制物质的量之比接近1:1通入足量氢氧化钠溶液可制NaNO2溶液。请写出该反应的离子方程式______________________________。
②将工业上氢氧化钠溶液脱硝得到的NaNO2、NaNO3的混合液和NaOH溶液分别加到下图所示的电解槽中进行电解。写出A室NO2发生的电极反应:____________________。

【答案】867kJmol-1 2mol < 0.0025molL-1min-1 0.25 正向 4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O SO2易溶于水,NO难溶于水,SO2溶于吸收剂中的浓度明显比NO大(或SO2的还原性强或脱硝反应活化能较高) NO+NO2+2OH-=2NO2-+ H2O 2NO2-+6e-+4H2O=8OH-+ N2↑
【解析】
(1)①依据已知的热化学方程式利用盖斯定律解答;
②若反应中还原NOx至N2,消耗标准状况下5.6LCH4,CH4被氧化为CO2,碳元素化合从-4价升高为+4价,可结合甲烷的物质的量,可计算反应中转移电子数目;
(2)①根据先拐先平数值大原则分析,先拐先平温度高;
②T1°C时,结合图像找出40~80 min N2的浓度变化量计算v(N2),利用三段式计算化学平衡常数K;
③T1°C下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,根据Qc与K的数值关系判断;
(3)①废气中的NO与NaClO2反应,NaClO2具有氧化性,NO具有还原性,发生氧化还原反应,生成NO3-、Cl-,据此写出反应的离子方程式;
②烟所中SO2和NO的水溶性存在明显差异,影响了复合剂对烟气中SO2、NO脱除效率;
(4)①NO、NO2 和足量氢氧化钠溶液发生氧化还原反应生成NaNO2和水;
②通过A室产生了N2,可知A极的电解质溶液为NaNO3和NaNO2的混合溶液,NO2-在A极放电为N2,则A为阴极;则B极为阳极,电解质溶液为NaOH溶液,OH-在B极放电,据此分析。
(1)①已知:Ⅰ.CH4(g)+ 4NO2(g) 4NO(g)+CO2(g)+ 2H2O(g) H1=574.0 kJ ·mol-1,
Ⅱ.CH4(g)+4NO(g) 2N2(g)+ CO2(g)+ 2H2O(g) H2= 1160.0 kJ·mol-1,
由盖斯定律:![]() 可得,CH4(g)+2NO2(g) N2(g)+CO2(g)+ 2H2O(g) H3= 867kJmol-1;
可得,CH4(g)+2NO2(g) N2(g)+CO2(g)+ 2H2O(g) H3= 867kJmol-1;
②还原NOx至N2,消耗标准状况下5.6LCH4,n(CH4)=0.25mol,根据反应可知,CH4转化为CO2,C元素由-4价变为+4价,1mol CH4参与反应转移8mol电子,0.25mol CH4参与反应整个过程中转移的电子物质的量为0.25mol×8=2mol;
(2)①根据先拐先平数值大原则,先拐先平温度高,则T1<T2,;
②T1°C时,结合图像,40~80 min ,NO2物质的量变化量=1.50mol-1.10mol=0.40mol,浓度变化量=![]() =0.20mol/L,根据反应CH4(g)+ 2NO2(g) N2(g)+CO2(g)+ 2H2O(g),浓度的变化量之比等于计量系数比,则N2的浓度变化量为0.10mol/L,则v(N2)=
=0.20mol/L,根据反应CH4(g)+ 2NO2(g) N2(g)+CO2(g)+ 2H2O(g),浓度的变化量之比等于计量系数比,则N2的浓度变化量为0.10mol/L,则v(N2)=![]() = 0.0025molL-1min-1;120min时T1°C下,反应达到平衡,平衡时NO2物质的量为1mol,利用三段式:
= 0.0025molL-1min-1;120min时T1°C下,反应达到平衡,平衡时NO2物质的量为1mol,利用三段式:
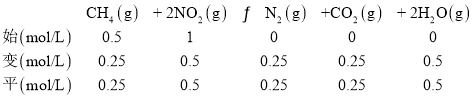
化学平衡常数K=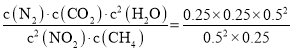 =0.25;
=0.25;
③T1°C下,200 min时,向容器中再加入CH4、NO2和H2O(g)各l mol,Qc=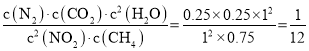 <K=0.25,则化学平衡正向移动;
<K=0.25,则化学平衡正向移动;
(3)①废气中的NO与NaClO2反应,NaClO2具有氧化性,NO具有还原性,发生氧化还原反应,生成NO3-、Cl-,则此反应的离子方程式为4NO+3ClO2-+4OH-=4NO3-+3Cl-+2H2O;
②SO2易溶于水,而NO难溶于水,导致吸收剂中SO2浓度明显比NO大,则SO2比NO脱除效率高;
(4)①将NO、NO2 控制物质的量之比接近1:1通入足量氢氧化钠溶液可制NaNO2溶液,该反应的离子方程式:NO+NO2+2OH-=2NO2-+ H2O;
②NO2在阴极得电子被还原为氮气,结合B室的溶液是碱性溶液,故放电的方程式为:2NO2+6e+4H2O=8OH+N2↑。


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】联苯(![]() )由两个苯环通过单键连接而成,假定二氯联苯(联苯分子两个氢原子分别被两个氯原子所取代)分子中苯环间的单键可以自由旋转,理论上由异构而形成的二氯联苯共有(不含立体异构)
)由两个苯环通过单键连接而成,假定二氯联苯(联苯分子两个氢原子分别被两个氯原子所取代)分子中苯环间的单键可以自由旋转,理论上由异构而形成的二氯联苯共有(不含立体异构)
A.12种B.13种C.14种D.15种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是世界上最大的钨储藏国,超细钨粉是生产硬质合金所必须的原料。
(1)工业上可以采用铝热还原法生产钨铁合金,已知:
①WO3(s)+2Al(s)=W(s)+Al2O3(s) H1
②3Fe3O4(s)+8Al(s)=9Fe(s)+4Al2O3(s) H2
则四氧化三铁与钨反应的热化学方程式为___(反应热写为H3并用含△H1、AH2的代数式表示);在反应②中若有0.1molFe3O4参加反应,则转移电子___mol。
(2)自然界中钨主要存在于黑钨矿中(主要成分是铁和锰的钨酸盐),从中制备出黄钨(WO3)后再用H2逐级还原:WO3→WO2.90→WO2.72→WO2→W,总反应为3H2(g)+WO3(s)![]() W(s)+3H2O(g) H,实验测得一定条件下平衡时H2的体积分数曲线如图所示:
W(s)+3H2O(g) H,实验测得一定条件下平衡时H2的体积分数曲线如图所示:
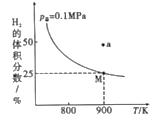
①由图可知,该反应的H____(填“>”或“<”)0;a点处的v正___v逆(填“>”“<”或“=”)。
②如果上述反应在体积不变的密闭容器中达到平衡,下列说法错误的是__(填序号)。
A.v正(H2)=v逆(H2O)
B.加入WO3,则H2的转化率增大
C.容器内气体的密度不变时,一定达到平衡状态
D.容器内压强不变时,一定达到平衡状态
③由图可知900K,氢气的平衡转化率为__,Kp(900K)=____(用平衡分压代替平衡浓度计算,已知:平衡分压=p总×气体物质的量分数)。
④已知在高温下,氧化钨会与水蒸气反应生成一种挥发性极强的水钨化合物WO2(OH)2,因此在反应中要适当加快氢气的流速,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,A遇甲的浓溶液发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体,上述物质的转化关系如下图所示,下列说法正确的是
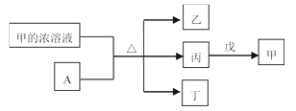
A.由于丁和戊化学键相同,所以它们都是平面结构
B.简单氢化物的沸点: X>Z
C.简单离子半径大小: X<Y
D.Y的简单离子与Z的简单离子在水溶液中可大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.乙酸和甲醛分别完全燃烧,若消耗的氧气量一样,则它们的质量相等
B.通过核磁共振氢谱可以区分CH3 CH2CH2OH和![]()
C.莽草酸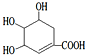 可以发生氧化、还原、酯化、加聚反应
可以发生氧化、还原、酯化、加聚反应
D.Cl2与甲苯在光照条件下反应,苯环上的氢原子被取代
查看答案和解析>>
科目:高中化学 来源: 题型:
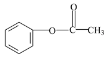
【题目】G是某抗炎症药物的中间体,其合成路线如下:
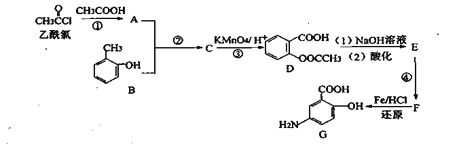
已知:①![]()
![]()
② ![]()
![]()
![]() (呈碱性,易氧化)
(呈碱性,易氧化)
(1)C的官能团名称是_______________;
(2)反应①的反应类型为___________;反应②的作用是___________________;
(3)下列对有机物G的性质推测不正确的是____________________ (填选项字母);
A.1molG与足量NaHCO3溶液反应放出2molCO2
B.能发生取代反应和氧化反应
C.能加聚合成高分子化合物
D.具有两性,既能与酸反应也能与碱反应
(4)写出E→F的化学反应方程式______________________________;
(5)同时符合下列条件的D的同分异构体有__________种:
①含有苯环且能发生水解反应:②能发生银镜反应;③能与NaHCO3溶液反应放出CO2。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位:苯环上有发基时,新引入的取代基连在苯环的问位。根据题中的信息,写出以甲苯为原料合成有机物的流程图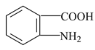 (无机试剂任选)_______________________________________________________________________________________。 合成路线流程图示例:X
(无机试剂任选)_______________________________________________________________________________________。 合成路线流程图示例:X![]() Y
Y![]() Z……目标产物
Z……目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①C(s)+O2(g)=CO2(g)△H1;
②C(s)+![]() O2(s)=CO(g)△H2;
O2(s)=CO(g)△H2;
③CO2(g)+C(s)=2CO(g)△H3;
④4Fe(s)+3O2(g)=2Fe2O3(s)△H4;
⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列判断正确的是( )
A.△H4是Fe的燃烧热
B.△H1>△H2
C.△H3=2△H2-△H1
D.3△H1-3△H2-![]() △H4+△H5=0
△H4+△H5=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,11.2L CO和CO2混合气体质量为20.4g,下列说法正确的是( )
A.混合气体中CO和CO2的质量比为1:4
B.混合气体中CO和CO2的体积比4:1
C.混合气体中CO和CO2的体积比1:4
D.混合气体中CO和CO2的平均相对分子质量为40.8g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
(1)用双线桥表示出电子转移的方向和数目__,题干中反应改写成离子方程式是___。
(2)电解食盐水的过程中,氧化产物是___。
(3)电解食盐水要求对粗食盐水进行精制,以除去租食盐水中含有的泥沙和SO42-、Ca2+,Mg2+等杂质离子。精制时依次加入氯化钡溶液、纯碱、烧碱,充分反应后过滤,在滤液中加入盐酸中和至中性。盐酸与滤液反应的离子方程式:___,___。
(4)请配平以下化学方程式:__Al+__NaNO3+__NaOH=__NaAlO2+__N2↑+__H2O。若反应过程中转移5mol电子,则生成标准状况下N2的体积为___L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com