
| A. | 醋酸的电离度增大 | B. | H+数目增多 | ||
| C. | c(H+)增大 | D. | 导电性减弱 |
分析 醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,根据醋酸的电离程度确定溶液中微粒个数变化.
解答 解:A.醋酸是弱电解质,加水稀释醋酸溶液,促进醋酸电离,则醋酸的电离程度增大,故A正确;
B.加水稀释醋酸,促进醋酸电离,溶液中氢离子总数增多,故B正确;
C.加水稀释醋酸,虽然促进醋酸电离,但是溶液体积增大程度大于氢离子物质的量增大程度,所以c(H+)减小,故C错误;
D.加水稀释醋酸,虽然促进醋酸电离,溶液中离子个数增多,但离子浓度降低,所以导电能力减弱,故D正确;
故选C.
点评 本题考查弱电解质的电离,明确弱电解质电离特点是解本题关键,注意稀释醋酸时溶液中氢离子、醋酸分子、醋酸根离子浓度都减小,但氢氧根离子浓度增大,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有⑤ | B. | 均能 | C. | ③④⑤ | D. | 均不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
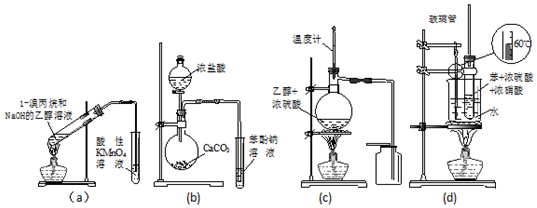
| A. | a装置直接用酸性KMnO4溶液检验消去反应的产物 | |
| B. | b装置检验酸性:盐酸>碳酸>苯酚 | |
| C. | c装置用于实验室制取并收集乙烯 | |
| D. | d装置用于实验室制硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
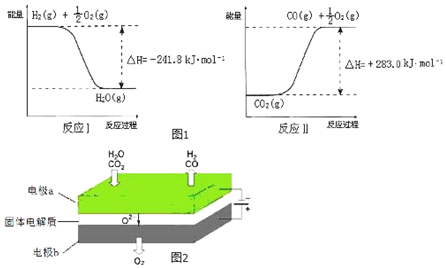
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟氯烃作制冷剂会加剧雾霾天气的形成 | |
| B. | 从海水中提取溴需经历氧化还原反应 | |
| C. | 加碘食盐中含有碘元素,能使淀粉溶液变蓝 | |
| D. | 工业上制漂白粉,所得的氯化物都具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
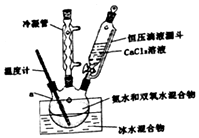 过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2
过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至150℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2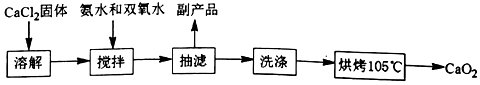
| 数据 时间 | 样品取用质量/(g) | 平均消耗体积(KMnO4)/mL |
| 放置前测定 | a | 25.00 |
| 放置一个月后测定 | a | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中加入硝酸银溶液时,生成白色沉淀,说明溶液中有Cl- | |
| B. | 某溶液中加入稀硫酸溶液时,生成无色气体,说明溶液中有CO32- | |
| C. | 某溶液中加入氯化钡溶液时,生成白色沉淀,说明溶液中有SO42- | |
| D. | 某溶液中加入盐酸溶液,无明显现象,再加入氯化钡溶液时,生成白色沉淀,说明溶液中有SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com