
25 ℃时,取浓度相同的NaOH和HCl溶液,以32体积比相混合,所得溶液的pH等于12,则原溶液的浓度为( )
A.0.01 mol·L-1 B.0.017 mol·L-1
C.0.05 mol·L-1 D.0.50 mol·L-1
科目:高中化学 来源: 题型:
I.近年来全国各地都遭遇“十面霾伏”。其中,机动车尾气和燃煤产生的烟气对空气质量影响严重,这是目前重要的研究课题 。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g) △H<0
2CO2(g)+ N2(g) △H<0
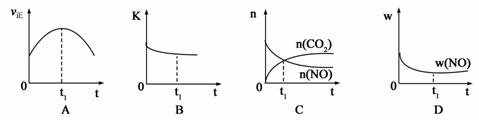
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。(下图中υ正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
 Ⅱ.利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关
Ⅱ.利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关
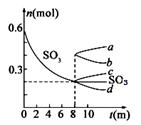
键步骤.T1℃时,在1L密闭容器中充入0.6molSO3,右图表
示SO3 物质的量随时间的变化曲线。
① 达到平衡时,用SO2表示的化学反应速率为 。
② 平衡时,SO3的转化率为 (保留小数点后一位);
T1℃时,反应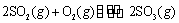 的
的
平衡常数为 ; 其他条件不变,在8min时压缩容器体积至0.5L,
则n(SO3)的变化曲线为 (填字母)。
③右表为不同温度(T)下,反应2SO2(g) + O2(g)  2SO3(g) (△H<0)
2SO3(g) (△H<0)
| T/℃ | T2 | T3 |
| K | 20.5 | 4.68 |
的化学平衡常数(K),由此推知,温度最低
的是 (填“T1”、“T2” 或 “T3)
查看答案和解析>>
科目:高中化学 来源: 题型:
根据碘与氢气反应的热化学方程式:
(ⅰ)I2(g)+H2(g)2HI(g)
ΔH=-9.48 kJ·mol-1
(ⅱ)I2(s)+H2(g)2HI(g)
ΔH=+26.48 kJ·mol-1
下列判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应(ⅰ)的产物比反应(ⅱ)的产物稳定
D.反应(ⅱ)的反应物总能量比反应(ⅰ)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
火力发电厂释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体会造成环境污染。对燃烧废气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排、废物利用等目的。
(1)脱硝:利用甲烷催化还原NO2:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)
ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g)
ΔH=-1 160 kJ·mol-1
甲烷直接将NO2还原为N2的热化学方程式为________________
_________________________________________________________。
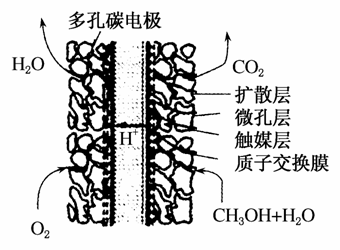
(2)某一甲醇燃料电池的结构如图所示。其工作时负极的电极反应式可表示为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液1 mL稀释至100 mL后,pH小于3
B.向该溶液中加入等体积、pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.200 0 mol·L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol·L-1盐酸、③0.1 mol·L-1氯化镁溶液、④0.1 mol·L-1硝酸银溶液中,Ag+浓度:①>④=②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:I2+2S2O ===S4O
===S4O +2I-
+2I-
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2·2H2O晶体,加入________,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=________。过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2·2H2O晶体。
(2)在空气中直接加热CuCl2·2H2O晶体得不到纯的无水CuCl2,原因是______________________________(用化学方程式表示)。由CuCl2·2H2O晶体得到纯的无水CuCl2的合理方法是____________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是______________________。
②CuCl2溶液与KI反应的离子方程式为__________________________。
③该试样中CuCl2·2H2O的质量百分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,E是具有果香气味的烃的衍生物。A、B、C、D、E在一定条件下存在如下转化关系(部分反应条件、产物被省略)。
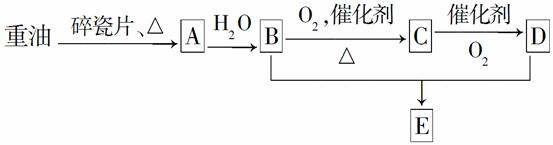
(1)工业上,由石油获得重油的方法是________,由重油获得A是________变化(填“物理”或“化学”)。A的名称为________。
(2)A—→B的反应类型是________;E的结构简式为________;写出C—→D的化学方程式:____________________________________。
(3)丁烷是由重油获得A的过程中的中间产物之一,写出它的两种同分异构体的结构简式:________________________________________,________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
元素X、Y和Z可结合形成化合物XYZ3(除硼元素外);X、Y和Z的原子序数之和为26;Y和Z在同一周期,下列有关推测正确的是( )
A.XYZ3是一种可溶于水的酸,且X与Y可形成离子化合物XY
B.XYZ3是一种微溶于水的盐,且X与Z可形成离子化合物XZ
C.XYZ3是一种易溶于水的盐,且Y与Z可形成离子化合物YZ
D.XYZ3是一种离子化合物,且Y与Z可形成离子化合物YZ2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com