
| A、向盐酸中滴加氨水:H++OH-=H2O |
| B、Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C、铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2 NO↑+4H2O |
| D、CuSO4溶液与Ba(OH)2溶液混合:Cu2++SO42-+2OH-+Ba2+=BaSO4↓+Cu(OH)2↓ |


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、非金属氧化物一定不是碱性氧化物 |
| B、HCl、H2S、NH3都是电解质 |
| C、漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器常用于物质分离 |
| D、Fe(OH)3、FeCl2、CuS都不能直接用化合反应制备 |
查看答案和解析>>
科目:高中化学 来源: 题型:
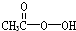 )是广为使用的消毒剂.它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2.测定产品中过氧乙酸浓度c0.涉及下列反应:
)是广为使用的消毒剂.它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2.测定产品中过氧乙酸浓度c0.涉及下列反应: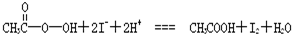
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al2(SO4)3溶液呈酸性的原因是Al3+水解,离子方程式为:Al3++3OH-═Al(OH)3 |
| B、以KOH溶液为电解质溶液的氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、测0.1mol/L氨水的pH为11:NH3?H2O?NH4++OH- |
| D、钢铁发生吸氧腐蚀的正极反应式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学家可以制造出自然界中不存在的物质 |
| B、化学研究的主要目的就是认识分子 |
| C、化学科学与其他科学分支的联系不密切 |
| D、化学研究会造成严重的环境污染,最终人类将毁灭在化学物质中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X:3d64s2 Y:2s22p4 |
| B、X:2s22p3Y:2s22p4 |
| C、X:3s23p1Y:3s23p4 |
| D、X:3s2Y:3s23p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
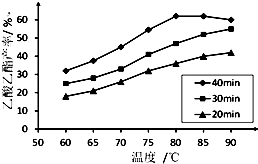 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:| 浓硫酸 |
| △ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com