
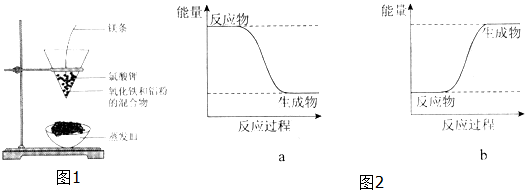
 Al2O3+2 Fe,其能量变化可用图2中的a(填“a”或“b”)表示.
Al2O3+2 Fe,其能量变化可用图2中的a(填“a”或“b”)表示. 分析 (1)根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱);
(2)反应剧烈,火星四射,漏斗下方有红热熔融物流出,说明该反应为放热反应,反应物总能量大于生成物总能量.
解答 解:(1)a.燃烧CO是放热反应,故错误;
b.氯化铵晶体与氢氧化钡晶体反应是吸热反应,故正确;
c.铝和稀盐酸的反应是放热反应,故错误;
d.NaOH溶液和稀盐酸反应是放热反应,故错误.
故选b;
(2)反应剧烈,火星四射,漏斗下方有红热熔融物流出,说明该反应为放热反应,方程式为:Fe2O3+2Al  Al2O3+2 Fe,反应物总能量大于生成物总能量,所以可用图2中的a表示,故答案为:放热;Fe2O3+2Al
Al2O3+2 Fe,反应物总能量大于生成物总能量,所以可用图2中的a表示,故答案为:放热;Fe2O3+2Al  Al2O3+2 Fe; a.
Al2O3+2 Fe; a.
点评 本题考查化学反应的热量变化,学生应注重归纳中学化学中常见的吸热或放热的反应,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素和非金属元素分界线附近的元素 | |
| B. | 右上方区域的非金属元素 | |
| C. | 过渡元素 | |
| D. | 稀有气体元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Cu2+、NO3- | B. | Na+、Fe2+、H+、NO3- | ||
| C. | NH4+、Cl-、SO42-、OH- | D. | HCO3-、Mg2+、Na+、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2晶体结构中,每个Si原子与2个O原子直接相连 | |
| B. | 通常状况下,60gSiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数) | |
| C. | 金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 | |
| D. | 1mol金刚石含4NAC-C键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ | |
| B. | 由水电离的c(H+)=10-12 mol/L的溶液:K+、Ba2+、Cl-、Br- | |
| C. | 在pH=12溶液中:NH4+、K+、NO3-、Cl- | |
| D. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com